Формирование инфицированных ран у лабораторных животных проводили в стандартных условиях: всем кролам, под общим обезболиванием, по паравертебральной линии с помощью металлической пластины с внутренним диаметром кольца 2,0 см, иссекали шкуру (рис. 4.17).

Рисунок 4.17. Подготовка лабораторного животного к эксперименту с моделированием инфицированной раны мягких тканей
Полученный дефект обрабатывали 70 % уксусной кислотой до получения некроза подкожной клетчатки и мышц (рис. 4.18).
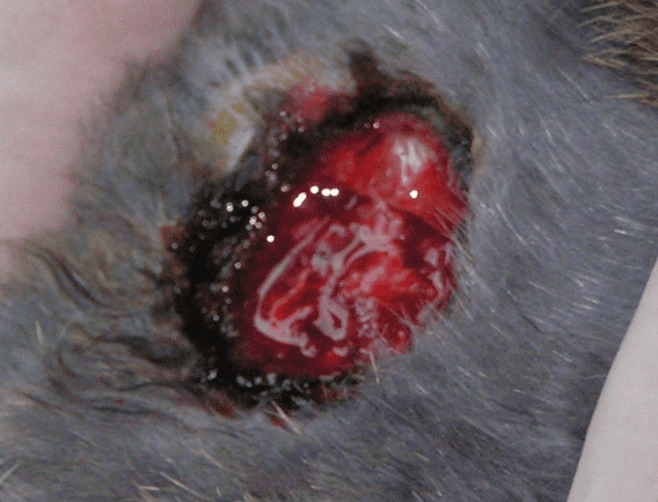
Рисунок 4.18. Состояние ран после обработки 70 % уксусной кислотой, первые сутки эксперимента.
Затем в рану вносили 500 тыс. КОЕ St. Aureus. Таким образом, спустя двое суток, к началу эксперимента, у всех животных были сформированы раны неправильно округлой формы до 2 см в диаметре (рис. 4.19).
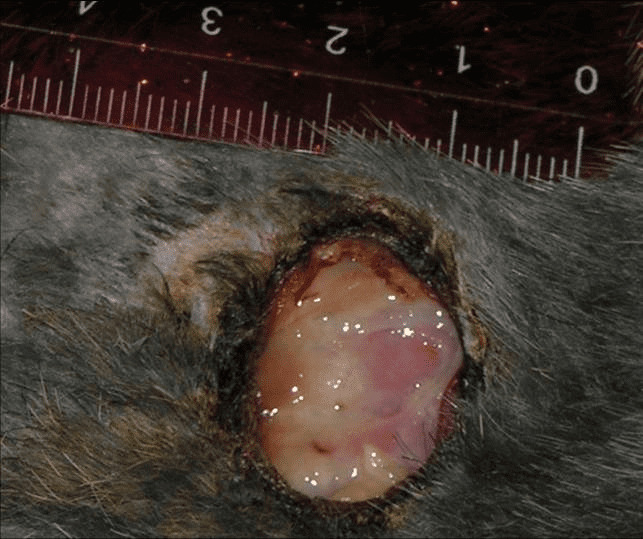
Рис. 4.19. Моделирование инфицированной раны мягких тканей
Вокруг раны очаг инфильтрации – до 3,5 см в диаметре. Стенки раны гиперемированы, плотные, спаяны с окружающими тканями, дно покрыто плотным налетом фибрина, выделяется до 2–3 мл гнойного отделяемого белесоватого цвета тестоватой консистенции. Глубина раневого дефекта достигала 2 см.
В день формирования раны, под местной анестезией, выполняли биопсию раны через все слои на глубину до 1,8–2,2 см. Материал фиксировали в 96 % этиловом спирте, заливали в парафин и готовили гистологические срезы, которые окрашивали гематоксилином Майера и эозином с последующим анализом морфологической картины.
До начала лечения у всех животных при гистологическом исследовании определялись очаги некроза в соединительной и мышечной тканях (рис. 4.20), расширение кровеносных сосудов со стазом крови, экссудация лейкоцитов.
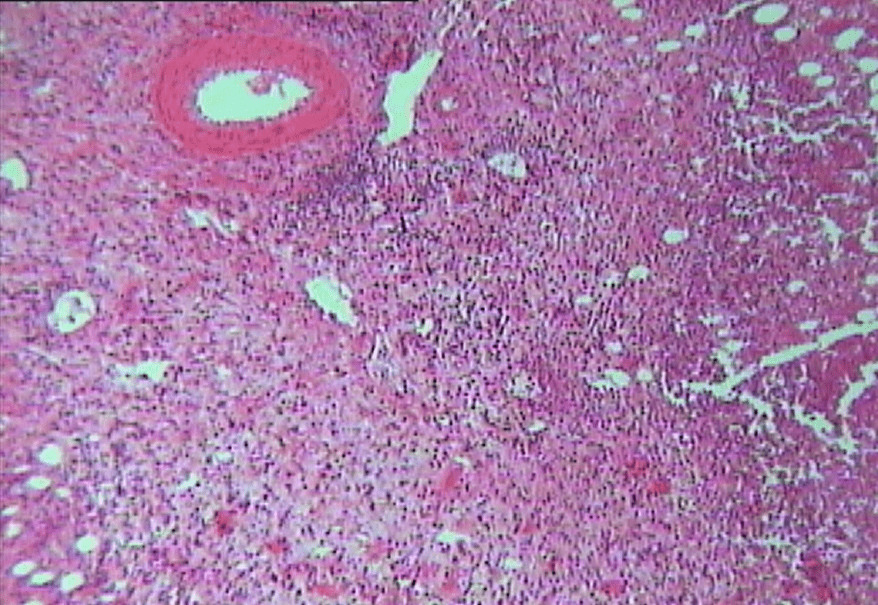
Рисунок 4.20. Характеристика ран до начала лечения. Окраска – гематоксилин Майера и эозин. УвХ 40. Очаги некроза в соединительной и мышечной тканях.
Сосочковый слой дермы имел четкое разграничение на слои: с выраженной клеточной инфильтрацией, представленной моноцитами, единичными макрофагами, и рыхлой соединительной тканью с большим количеством фиброцитов, единичными фибробластами, единичными моноцитами, плазмоцитами, очаги некроза замещены полиморфно-ядерными лейкоцитами, при этом также определяются и мононуклеарные лимфоциты (рис. 4.21).
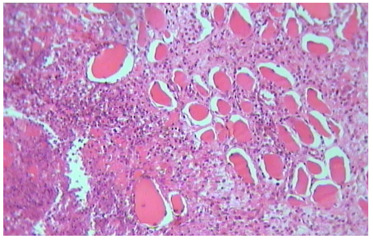
Рисунок 4.21. Характеристика ран до начала лечения. Окраска – гематоксилин Майера и эозин. УвХ 40
Лечение животных начинали через пять суток после формирования инфицированной раны мягких тканей. Животные были разделены на четыре группы: экспериментальная группа и три группы контроля (по 20 кролов в каждой). В каждой группе один раз в сутки выполняли перевязку с определенным для каждой группы типом лечения:
Группа I – экспериментальная группа в рану вносили активатор оригинального состава. После подсушивания и образования пленки из геля в течение 3–5 минут на рану накладывали сухую стерильную салфетку;
Группа II – (контроль основы) в рану вносили только основу активатора в виде геля гидроксиметилцеллюлозы
Группа III – (традиционное лечение) лечение проводили традиционным методом в зависимости от фазы течения раневого процесса: в фазу воспаления применяли повязки с мазями на водной основе, в фазу регенерации и эпителизации – с мазями на жировой основе;
Группа IV – (без лечения) после обработки на рану накладывалась сухая стерильная салфетка.
На первые, третьи, пятые, седьмые, десятые и пятнадцатые сутки оценивали размеры раневого дефекта, наличие отека, гиперемии, отделяемого из раны и его характер.
Во всех группах контроля на первые сутки раны сохраняли свои размеры. При этом стенки ран сохраняли свою плотность, спаяны с окружающими тканями, вокруг раны сохраняется плотный инфильтрат, при механическом воздействии из раны выделяется гной, дно раны покрыто гнойной пленкой (рис. 4.22).
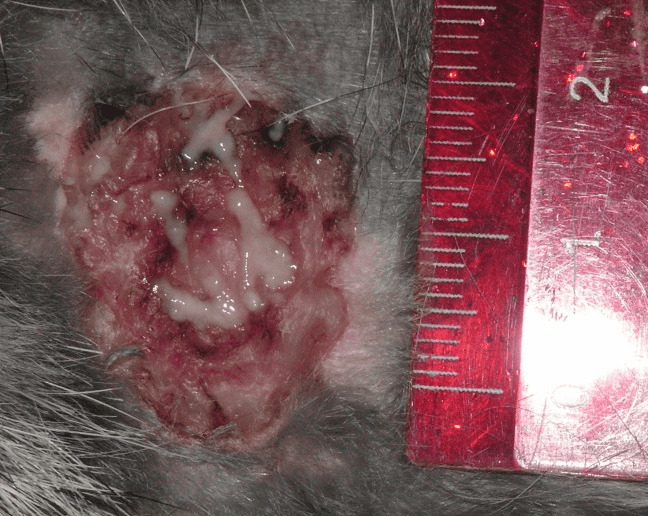
Рисунок 4.22. Состояние инфицированной раны мягких тканей в первые сутки эксперимента
На первые сутки в группе I (экспериментальной) раневой дефект сохранял свои размеры до 1 см в диаметре. Вокруг раны сохранялась умеренная гиперемия кожи, стенки раны были мягкие при пальпации, дно раны было покрыто налетом фибрина, гноя не наблюдалось (рис. 4.23).
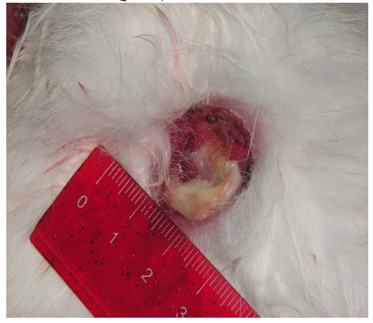
Рисунок 4.23. Состояние инфицированной раны мягких тканей животных в группе I (экспериментальной). Первые сутки лечения
На третьи сутки наблюдалось уменьшение размеров дефекта ткани до 0,5 см в диаметре, рана покрыта струпом бледно-серого цвета, вокруг зона краевой эпителизации до 5,0 мм шириной (рис. 4.24).
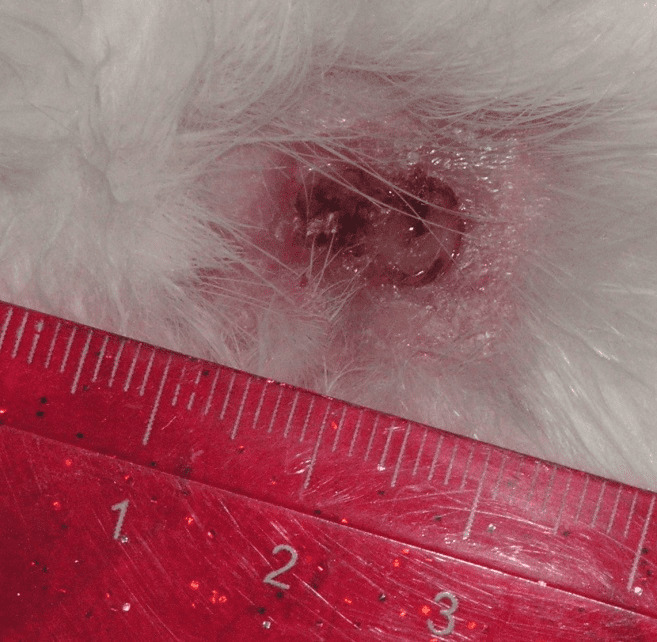
Рисунок 4.24. Состояние инфицированной раны мягких тканей в группе I (экспериментальной). Третьи сутки эксперимента.
В экспериментальной группе I на пятые сутки эксперимента наблюдалось закрытие раны более чем на 70 % и отмечалась краевая эпителизация с оволосением (рис. 4.25).
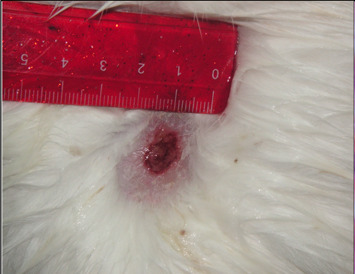
Рисунок 4.25. Состояние инфицированной раны мягких тканей в группе I животных. Пятые сутки эксперимента.
В экспериментальной группе I на десятые сутки эксперимента наблюдалась полная эпителизация раневого дефекта с его оволосением, гистологическая картина эпителизации раны с сохранением всех функционирующих структур. Эпителизация раны происходила без образования соединительнотканного рубца с восстановлением функции поврежденного участка, подтверждаемой ростом волосяного покрова (рис. 4.26).
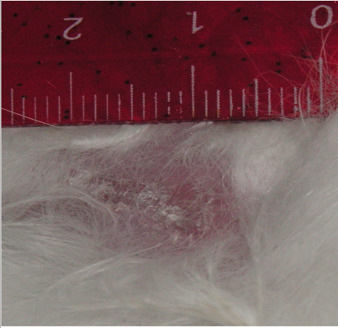
Рисунок 4.26. Состояние инфицированной раны мягких тканей животных в экспериментальной группе I. Десятые сутки эксперимента.
У животных II группы (контроль основы) раны сохраняли свои размеры до десяти суток эксперимента, при гистологическом исследовании определялся отек, лимфогистиоцитарная инфильтрация и дегенеративно-дистрофические изменения подкожной клетчатки, мышечного слоя (рис. 4.27). Закрытие раневого дефекта не происходило. Как видно на фото, в эти сроки несколько сокращались размеры раневого дефекта (1,6–1,9 см в диаметре), рана была покрыта налетом фибрина, края и стенки раны были плотные.
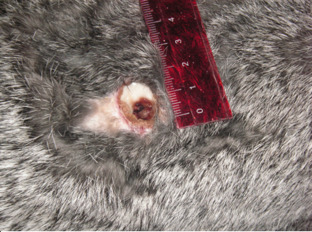
Рисунок 4.27. Состояние инфицированной раны мягких тканей в II группе животных (контроль основы). Десятые сутки эксперимента. 25 сутки эксперимента.
В группе III (традиционное лечение) в течение раневого процесса прослеживались все фазы: экссудации, пролиферации и регенерации (рис. 4.28).
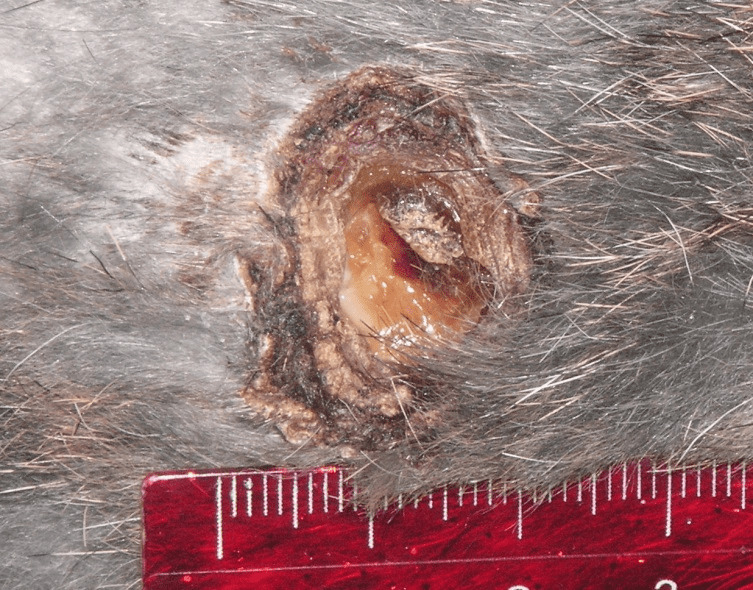
Рисунок 4.28. Состояние инфицированной раны мягких тканей в III группе животных (традиционное лечение). 20 сутки эксперимента.
Закрытие раневого дефекта произошло к 25 суткам с формированием грубого соединительнотканного рубца (рис. 4.29).
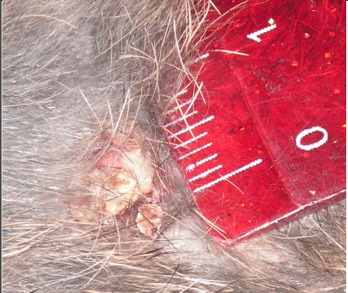
Рисунок 4.29. Состояние инфицированной раны мягких тканей в III группе животных (традиционное лечение). 25 сутки эксперимента.
В группе IV у пяти животных на 5 сутки развилась флегмона подкожной клетчатки, что привело к гибели животных. У оставшихся животных добиться закрытия раневого дефекта к 25 суткам эксперимента не удалось и животные были выведены из эксперимента (рис. 4.30).
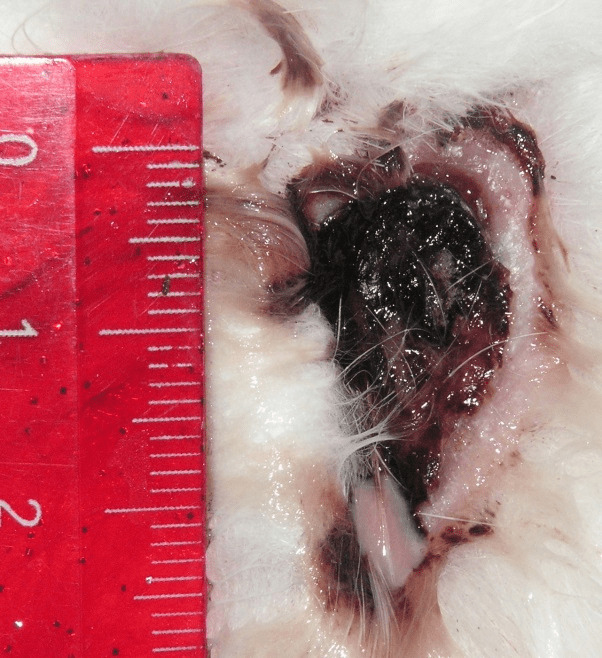
Рисунок 4.30. Состояние инфицированной раны мягких тканей. 25 сутки эксперимента. Группа IV. Раны сохраняют свои размеры, дно раны покрыто некротическими массами, из раны обильно выделяется гнойное отделяемое.
Таким образом в экспериментальной группе (I) после применения действующего вещества активатора, очищение раны от гнойно-некротических тканей происходило на 1–3 сутки лечения, а эпителизация раневого дефекта заканчивалась к 5–7 суткам эксперимента, с восстановлением волосяного покрова. В группах контроля очищение раны от гнойно-некротических тканей происходило к 15–20 суткам в лучшем случае (группа II – контроль основы), закрытие раневого дефекта с формированием грубого соединительнотканного рубца – к 20–30 суткам (группа III – традиционное лечение) (рис. 4.31).

Рисунок 4.31.. Визуальное сравнение динамики состояний при лечении инфицированной раны мягких тканей. Группа III (традиционное лечение) – верхний ряд и группа I (экспериментальная) – нижний ряд.
Клинический эффект применения действующего вещества активатора ксеногенного происхождения позволил сделать вывод об индуцирующем влиянии на течение процессов репаративной регенерации.
При гистологическом исследовании, на третьи сутки у животных в экспериментальной группе I в ране определялась рыхлая соединительная ткань с лейкоцитарной инфильтрацией, единичными укрупненными фибробластами, лимфоцитами, плазмоцитами, эозинофилами и моноцитами. Очаги пролиферации эндотелия сосудов были без просвета, с многорядностью расположения ядер (рис. 4.32).
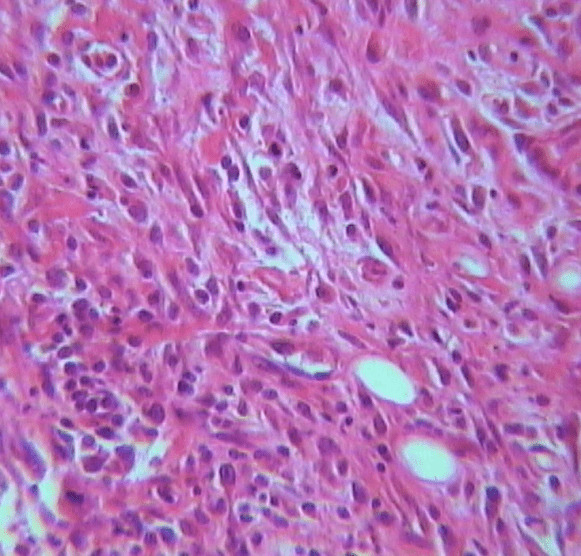
Рисунок 4.32. Пятые сутки эксперимента. Экспериментальная группа I. Окраска – гематоксилин Майера и эозин. УвХ 90
На 10 сутки эксперимента гистологически отмечалась пролиферативная активность клеток фибробластического ряда, трубчатая пролиферация фибробластов и эндотелия сосудов. В подкожной клетчатке определялись неповрежденные нервные стволики, что соответствовало гистологической картине эпителизации раны с сохранением всех функционирующих структур (рис. 4.33).
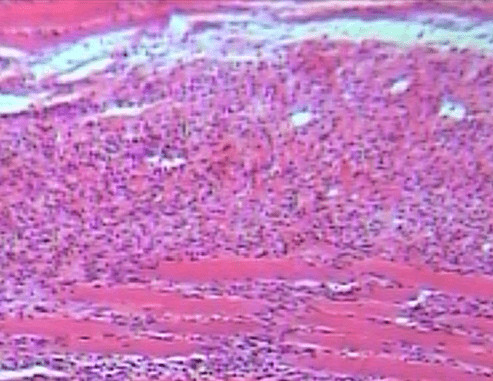
Рисунок 4.33. Экспериментальная группа I. Десятые сутки эксперимента. Окраска – гематоксилин Майера и эозин. УвХ 20
У животных II группы (контроль основы), до десятых суток эксперимента определялся отек, лимфогистиоцитарная инфильтрация и дегенеративно-дистрофические изменения подкожной клетчатки, мышечного слоя (рис. 4.34).
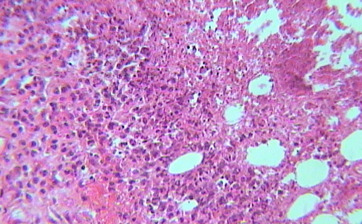
Рисунок 4.34. Группа II (контроль основы). Десятые сутки эксперимента. Окраска – гематоксилин Майера и эозин. УвХ 20
В группе III (традиционное лечение) к 25 суткам сохранялись дегенеративно-дистрофические изменения подкожной клетчатки и мышц, дегенеративные изменения нервных стволиков (рис. 4.35).
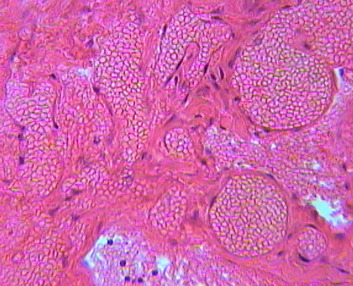
Рисунок 4.35. Группа III (традиционное лечение). 25 сутки. Дегенеративные изменения нервных стволиков. Окраска – гематоксилин Майера и эозин. Увеличение 40.
Таким образом, при применении активатора ксеногенного происхождения (группа I) отмечалось выгодное от остальных групп животных равномерное формирование соединительной ткани по всему дефекту. Эпителизация проходила успешно – эпидермис имел все признаки дифференцировки, дистрофически не изменился. Подкожная жировая клетчатка в воспалительные процессы не была вовлечена. Реструктуризация дермы происходила с нарастанием пула грануляций, стимуляцией миграции и пролиферации фибробластов, кератиноцитов, эндотелиальных и других клеток, что способствовало восстановлению эластичности ткани, сокращению времени восстановления и отсутствию осложнений.
В процессе заживления ран на этапе гнойно-некротической фазы преобладающей формой клеток был нейтрофильный клеточный пул, что обеспечивало активное противостояние бактериальной флоры и иммунной системы. Для перепроверки этих фактов идентифицировались клетки, экспрессирующие на мембране рецептор СD4+.
Общее количество клеток данной субпопуляции снижается по сравнению с клетками здоровой кожи (9,33±0,26 и 13,85±0,19 соответственно). Известно, что рецепторы СD4 присутствуют преимущественно на Т-лимфоцитах и, будучи комплементарными HLA-антигенам II класса, обеспечивают контакт Т-клеток с макрофагально-гистиоцитарным микроокружением. В процессе заживления раны наблюдалось периваскулярное разрежение Т-клеток по сравнению с нормальной здоровой кожей. Также уменьшалось количество антиген представляющих клеток Лангерганса СD68+ (25,7±0,29 и 34,0±0,32 соответственно), а следовательно, и их способность вступать в межклеточные взаимодействия при реализации адаптивного иммунного ответа. Снижалась миграционная активность клеток СD68+, на их поверхности уменьшалось число молекул адгезии, продуктов генов главного комплекса гистосовместимости II класса и костимулирующих молекул.
Нарушение хода физиологической регенерации и появление участков гипертрофии связано с нарушением функции антигенпрезентации клеток Лангерганса, их расположением в подлежащей эпителию соединительной ткани на фоне снижения количеств, что может свидетельствовать о нарушении антигенпредставления в структурах кожи человека и последующем снижении контроля за физиологической и репаративной регенерацией в целом, запуске процесса адаптивной гипертрофии в структурах кожи для сохранения барьерных свойств эпителия. Наблюдалось снижение пула тучных клеток СD204+ (2,17±0,2 и 4,0±0,18 соответственно), а также их дегрануляция. Численность моноцитов кожи СD14+ достоверно увеличивалась: 11,5±1,4 в ране и 4,34±0,49 в контроле.
В условиях повреждения кожи возникает повышенный запрос ткани на миграцию макрофагов для фагоцитоза некротизированных клеток, а также для защиты от контаминирующих микроорганизмов. Регенераторный процесс в коже сопровождается ее поражением и ремоделированием, вызванным хроническим воспалением. Эти изменения кожи связаны с утолщением и увеличением осаждения коллагена в дерме.
В фазу эпителизации происходит восстановление кожного покрова с формированием рубца и окончательное заживление раны. В зоне раны и подлежащей верхним слоям соединительной ткани визуализировались активированные макрофаги, характеризующиеся экспрессией СD163+, и фибробласты, отвечающие за реструктуризацию кожного покрова. Для обеспечения максимальной защиты раны от внешних воздействий и полноценной регенерации появляются СD8+-лимфоциты, продуцирущие те же цитокины, что и СD4+-Тх1 (ФНОα и ФНОβ, ИЛ-2,3, ИФγ, ГМ-КСФ).
Это наблюдение устанавливает роль клеток кожи в процессе репаративной регенерации в условиях гнойно-инфицированной раны. В частности, выявлено угнетение T-клеточного звена, снижение количества клеток Лангерганса и тучных клеток кожи в фазу воспаления, что приводит к извращению антигенпрезентации и нарушению в дальнейшем иммунных клеточных взаимодействий, а также нормального хода регенерации эпидермиса и дермы.
Кроме того, в экспериментальной группе I при применении активатора на 1–3 сутки эксперимента наблюдался рост носителей CD95+ с последующим его снижением, начиная с 3–5 суток. С первых суток наблюдался рост носителей маркера Ki67+ и продолжался до 15 суток эксперимента. На 3–5 сутки возникает «перекрест маркеров», что характеризует переход первой фазы раневого процесса во вторую: завершение процессов гибели клеток и начало активных пролиферативных процессов. В группе контроля традиционного лечения наблюдалось снижение уровня маркера готовности клеток к апоптозу. На пятые сутки эксперимента отмечался всплеск уровня маркера пролиферации с дальнейшим его снижением практически до нуля. В эпидермисе рубцов обнаруживались активные процессы пролиферации. Метка локализовалась в ядрах клеток базального и шиповатого слоя. В дерме метка присутствовала в округлых клетках. Они имеются в сосудах и между коллагеновыми волокнами зоны роста. Возможно, это клетки фибробластического ряда. Экспрессия белка Fas, свидетельствующая о том, что эпидермоциты готовы к апоптозу, была обнаружена в клетках базального и шиповатого слоя. В дерме метки не наблюдалось.
Значительное (в пять раз) ускорение очищения раны в первую фазу раневого процесса в экспериментальной группе I по сравнению с группами контроля, а также эпителизация раны без образования соединительнотканного рубца с восстановлением функции поврежденного участка (рост волосяного покрова) связаны с индуцирующим влиянием активатора ксеногенного происхождения на способ гибели клеток в первую фазу раневого процесса и характеризуют потенцирование механизмов репаративной регенерации.
Это подтверждается и данными полученными при иммуногистохимическом исследовании. До начала лечения количество клеток, экспрессирующих маркер CD95+ и маркер пролиферации – Ki67+, было одинаково высоко во всех экспериментальных группах. Динамика проапоптотического маркера CD95+ и маркера готовности клеток к пролиферации Ki67+ представлена в табл. 4.8 и 4.9.
Таблица 4.8. Динамика проапоптотического маркера CD95+
|
Срок эксперимента |
Группы животных |
|||
|
I |
II |
III |
IV |
|
|
До лечения |
5 % |
5 % |
7 % |
4 % |
|
1 сутки |
10 % |
4 % |
5 % |
5 % |
|
3 сутки |
8 % |
2 % |
5 % |
3 % |
|
5 сутки |
6 % |
0 % |
4 % |
1 % |
|
10 сутки |
5 % |
0 % |
3 % |
0 % |
|
15 сутки |
2,5 % |
0 % |
4 % |
0 % |
До начала лечения во всех группах выявлялся одинаковый уровень маркера CD95+. На первые сутки эксперимента в I группе уровень маркера CD95+ вырастал в два раза – 10 % – и оставался высоким до пяти суток (5–8 %).
Таблица 4.9. Динамика маркера готовности клеток к пролиферации Ki67+
|
Срок эксперимента |
Группы животных |
|||
|
I |
II |
III |
IV |
|
|
До лечения |
1 % |
1 % |
1 % |
1 % |
|
1 сутки |
2 % |
2 % |
3 % |
2 % |
|
3 сутки |
5 % |
2 % |
2 % |
1 % |
|
5 сутки |
7 % |
0 % |
6 % |
1 % |
|
10 сутки |
8 % |
0 % |
0,5 % |
0 % |
|
15 сутки |
10 % |
0 % |
1 % |
0 % |
Начиная с третьих суток в I (экспериментальной) группе нарастал уровень Ki67+ (4–5 %) и сохранил свои значения до 15 суток эксперимента (8–11 %). В группе II (контроль основы) наблюдался умеренный рост CD95+ и Ki67+, в группе III (традиционное лечение) на 3–5 сутки уровень маркеров не отличался от исходного.
До 15 суток эксперимента в экспериментальной группе I сохранялся высокий уровень Ki67+ (8–11 %), в группах контроля уровень CD95+ и Ki67+ стремился к нулю (0–4 %).
При этом, исследуя количество лимфоцитов с активированным CD95+, установили одинаковый уровень маркера во всех группах до начала лечения (рис. 4.36).
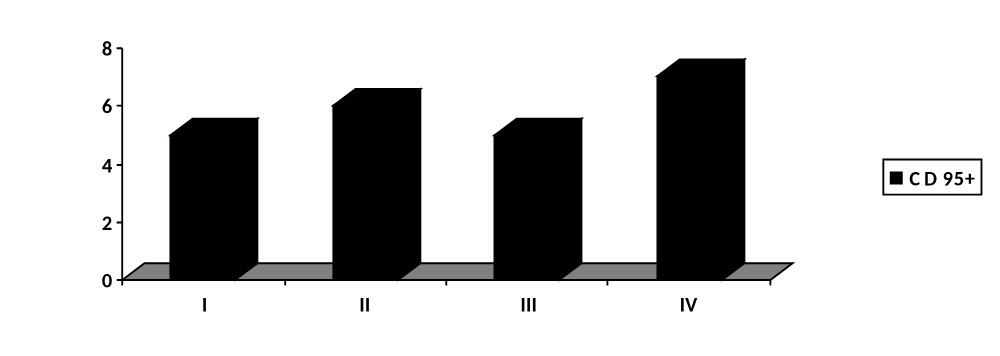
Рисунок 4.36. Уровень CD95+ инфицированных ран мягких тканей в группах сравнения до лечения
Также во всех группах наблюдался примерно одинаковый уровень маркера пролиферации – Ki67+ (рис. 4.37).
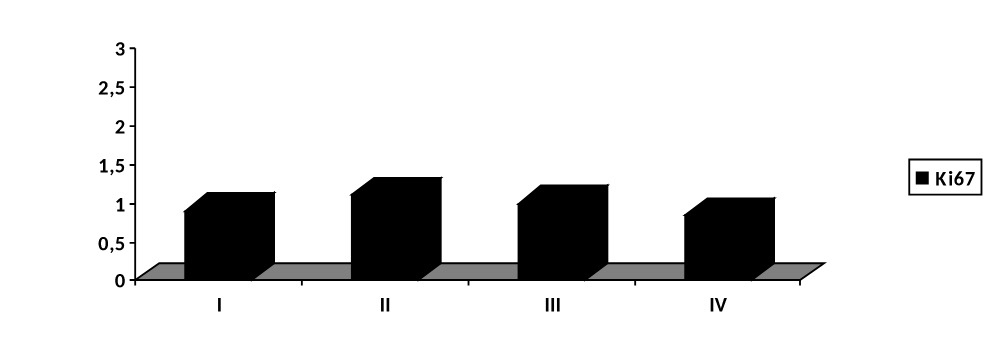
Рисунок 4.37. Уровень Ki67+ инфицированных ран мягких тканей в группах сравнения до лечения
В экспериментальной группе I при применении клеток-предшественниц на 1–3 сутки эксперимента наблюдался рост носителей CD95+ с последующим его снижением, начиная с 3–5 суток. С первых суток наблюдается рост носителей маркера Ki67+и продолжался до 15 суток эксперимента. На 3–5 сутки возникает «перекрест маркеров» (рис. 4.38), что характеризует переход первой фазы раневого процесса во вторую: завершение процессов гибели клеток и начало активных пролиферативных процессов.
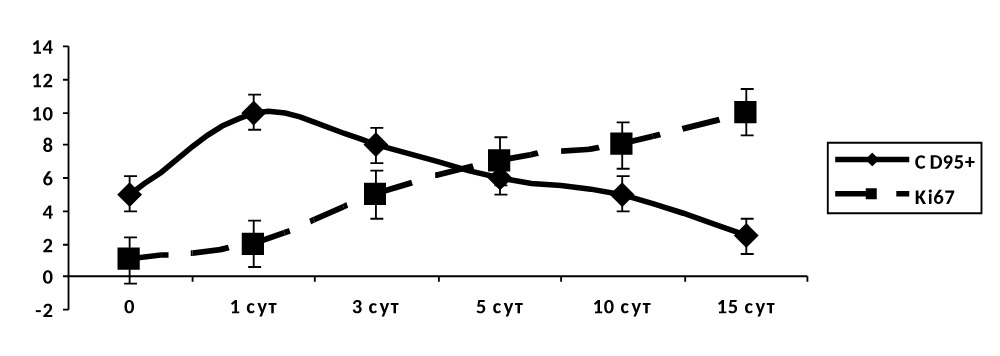
Рисунок 4.38. Группа I (экспериментальная). Динамика маркеров апоптоза и пролиферации при применении клеток-предшественниц в лечении инфицированной раны мягких тканей
В группе II (контроль основы) к 3–5 суткам наблюдался резкое падение как маркера готовности клеток к апоптозу, так и маркера пролиферации (рис. 4.39).
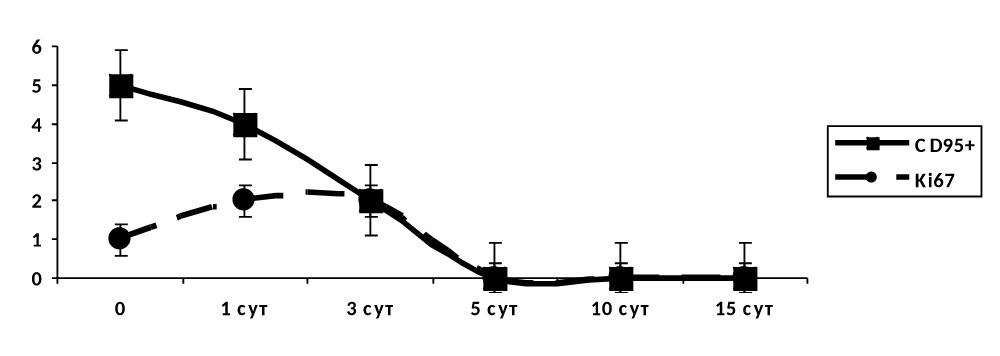
Рисунок 4.39. Группа II (контроль основы). Динамика маркеров апоптоза и пролиферации
В группе III (традиционное лечение) наблюдался снижение уровня маркера готовности клеток к апоптозу, на пятые сутки эксперимента отмечается некоторый всплеск уровня маркера пролиферации с дальнейшим его уменьшением практически до нуля (рис. 4.40).
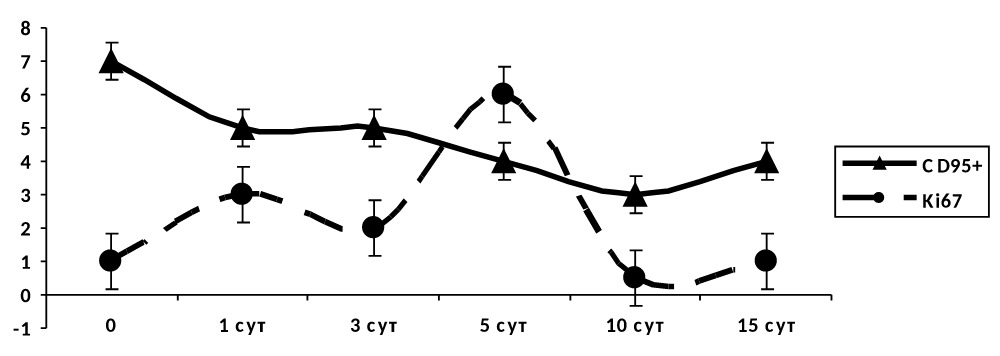
Рисунок 4.40. Группа III (традиционное лечение). Динамика маркеров апоптоза и пролиферации
В группе IV (без лечения) к 3–5 суткам наблюдался резкое падение как маркера готовности клеток к апоптозу, так и маркера пролиферации (рис. 4.41).
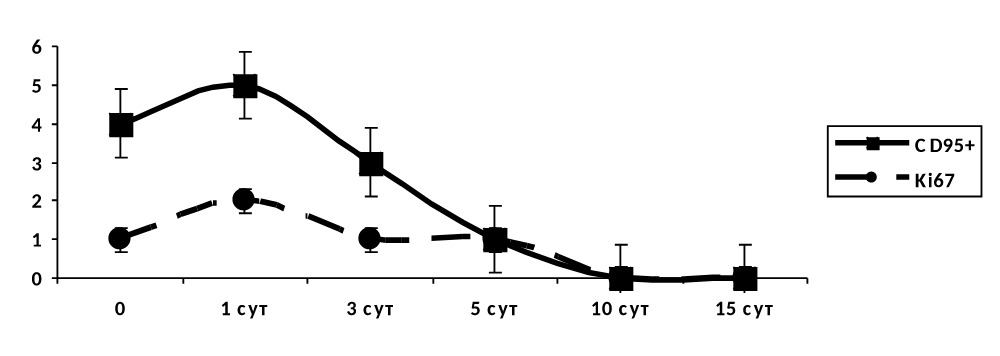
Рисунок 4.41. Группа IV (без лечения). Динамика маркеров апоптоза и пролиферации
Таким образом, активатор ксеногенного происхождения, является индуктором апоптоза в первую фазу раневого процесса. Во вторую и третью фазы раневого процесса данное вещество индуцирует механизмы физиологической репаративной регенерации. Применение этих свойств в качестве индукторов апоптоза и пролиферации открывает новые перспективы регуляции раневого процесса. В том числе в инфицированных ранах.
Дополнительно оценивалась антибактериальная активность по общепринятой методике Bauer A.W. (1966) «Определение чувствительности микробов к антибиотикам методом диффузии в агар с применением бумажных дисков» (рис. 4.42).
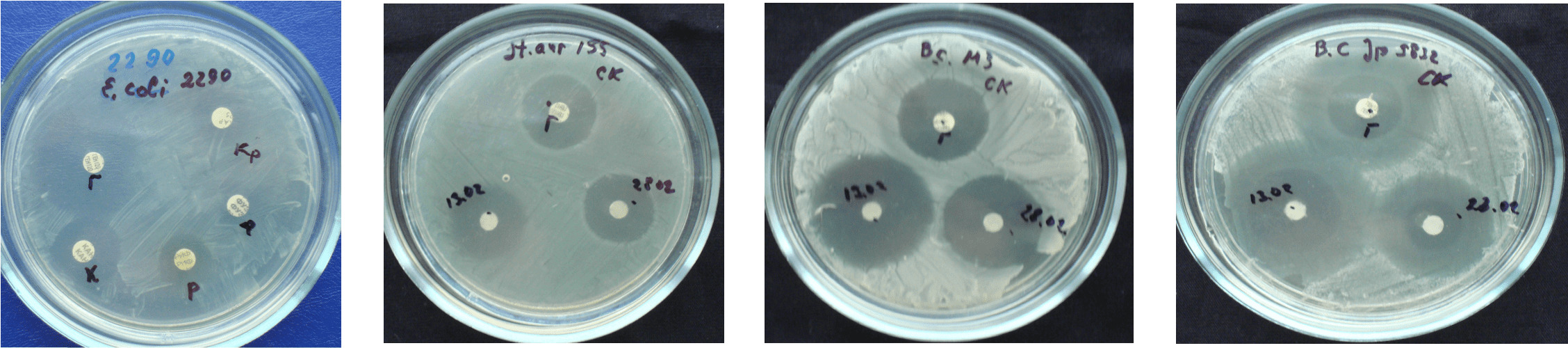
Рисунок 4.42. Оценка антибактериальной активности действующего вещества активатора ксеногенного происхождения по методике «Определение чувствительности микробов к антибиотикам методом диффузии в агар с применением бумажных дисков» в отношении St. aureus 155, E. Coli 2290, B. cereus Jp 5832.
Получены следующие результаты (табл.4.10 и 4.11).
Таблица 4.10. Оценка антибактериальной активности антибиотиков широкого спектра действия и тестируемой субстанции в отношении St. aureus 155
|
Исследуемые средства |
n |
Диаметр зоны подавления (мм) |
|
«Цефазолин» |
10 |
16,6 ± 0,7 |
|
«Канамицин» |
10 |
11,16 ± 0,9 |
|
«Карбенициллина динатриевая соль» |
10 |
22,8 ± 1,5 |
|
«Гентамицина сульфат» |
10 |
23,1 ± 1,8 |
|
«Рифампицин» |
10 |
13,8 ± 0,6 |
|
Супернатант, содержащий продукты жизнедеятельности клеток |
10 |
23,6 ± 1,4 |
|
«Активатор ксеногенного происхождения» |
10 |
32,7 ± 2,1 |
Таблица 4.11. Оценка антибактериальной активности антибиотиков широкого спектра действия и тестируемой субстанции в отношении E. Coli 2290
|
Исследуемые средства |
n |
Диаметр зоны подавления (мм) |
|
«Канамицин» |
10 |
20,06 ± 0,7 |
|
«Карбенициллина динатриевая соль» |
10 |
15,8 ± 1,1 |
|
«Гентамицина сульфат» |
10 |
30,1 ± 1,9 |
|
«Рифампицин» |
10 |
15,6 ± 0,9 |
|
Суспензия фетальных клеток |
10 |
24,9 ± 2,0 |
|
Супернатант, содержащий продукты жизнедеятельности клеток |
10 |
21,15± 0,7 |
|
«Активатор ксеногенного происхождения» |
10 |
29,8 ± 0,6 |
Диаметры зон подавления роста St. aureus 155 действующим веществом (32,7±2,1 мм) достоверно больше «Гентамицина сульфата» (23,1±1,8 мм соответственно). Действующее вещество также обладает высокой активностью в отношении E. Coli 2290 и B. cereus Jp 5832.
Таким образом, активатор, полученный авторским способом, при попадании в рану, взаимодействует с клетками CD34+, находящимися в базальном слое эпидермиса, луковице волосяного фолликула и эндотелия сосудов с эмбрионального периода особи. Действуя как катализатор грануляционного роста, стимулируя собственный ростковый пул эндотелиоцитов в ране и обладая антибактериальной активностью, запускает процессы репаративной регенерации кожи. Эти результаты стали основой дальнейших научных исследований и практических реализаций обнаруженных свойств для кожи человека.