Работа выполнена в отделении дерматологии Многопрофильного медицинского учреждения NEO-CLINIC, Тюмень.
Дизайн исследования представлен на рис. 2.1.
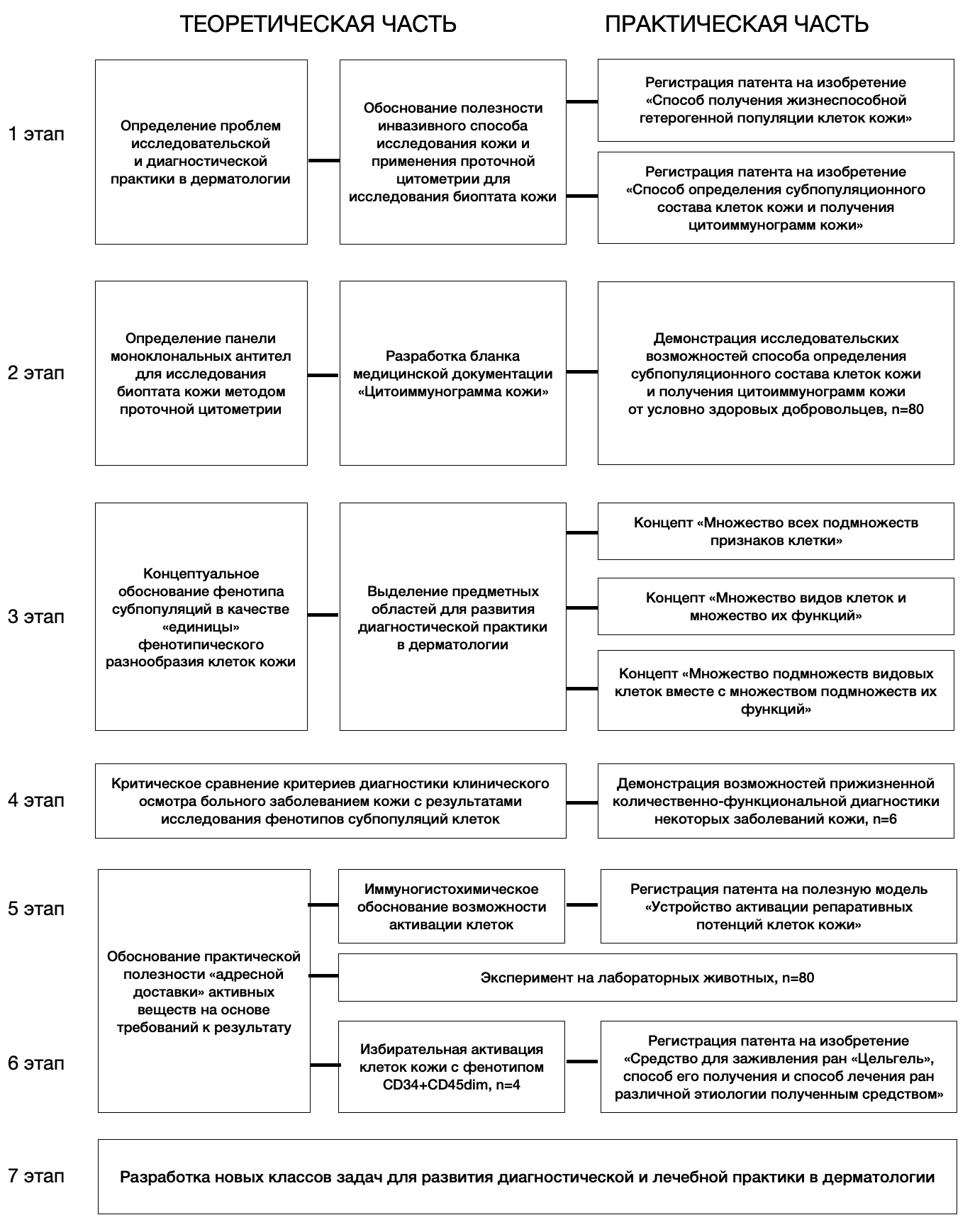
Рисунок 2.1. Дизайн исследования
Всего в исследовании было задействовано 100 добровольцев, из них 80 условно здоровых лиц для оценки применения проточной цитометрии, 6 пациентов с социально-значимыми хроническими заболеваниями кожи в основе которых лежат иммунные механизмы для демонстрации новых диагностических возможностей цитоиммунограмм кожи и 4 пациента для демонстрации применения разработанной полезной модели – амплификатора репаративных потенций.
Было осуществлено 180 биопсий кожи, из них:
160 с области верхненаружного квадранта ягодицы у 80 условно здоровых лиц, из них 80 для исследования криоконсервированных биоптатов,
12 с области инфильтратов морфологических элементов сыпи у 6 пациентов до начала лечения и после достижения клинического выздоровления,
8 у пациентов с повреждениями кожи, из них 4 с области неповрежденной кожи для получения культуры клеток и 4 с восстановленной области для оценки результата заживления.
Кроме того, в экспериментальной части исследования было задействовано 80 лабораторных животных – половозрелые кролики–самцы. Содержание и экспериментальные процедуры проводились в соответствии с правилами Совета Европейского сообщества (Директива 86/309/ЕЕС от 24.11.1986). Использовалась модель инфицированной раны мягких тканей (Патент РФ № 2006122640).
Для решения поставленных задач в работе использовался комплекс дополняющих друг друга методов исследования: punch-биопсии, механической гомогенизации тканей, метод проточной цитометрии, метод криоконсервации тканей, метод культивирования тканей, метод иммуногистохимии метод системного анализа, метод концептуализации предметных областей, метод двухколенного восхождения от эмпирически конкретного к теоретически конкретному через абстрактное, метод родоструктурной экспликации понятий, методы исчисления высказываний и методы статистической обработки данных.
Экспериментальное построение цитоиммунограмм кожи проводится с использованием инвазивного способа, включающего в себя забор биоптата кожи на глубину 2 мм с помощью инструмента для панч-биопсии 2 мм.
При взятии материала панч направлялся перпендикулярно поверхности кожи, с надавливанием сверху вниз и вращением его по часовой стрелке и против нее до погружения на требуемую глубину. После панч аккуратно вынимался. С помощью иглы биоптат извлекался из полости и хирургическим лезвием отсекался по нижнюю часть образца от тела пациента. На образовавшуюся ранку накладывался шов и бактерицидный пластырь. Полученный образец кожи исследовался ex tempore и после криоконсервации методом проточной цитометрии с фенотипированием клеточной суспензии.
Биоптат кожи от каждого добровольца, принявшего участие в исследовании, заливался 1 мл 0,9 % водного раствора хлорида натрия и помещался в рабочую камеру автоматической системы для механической гомогенизации ткани Medimachine (Becton Dickinson, США). Гомогенизация ткани проводилась в течение 30 секунд при температуре +23 °С. Гомогенат извлекался стерильным шприцем. Рабочая камера гомогенизатора трижды вымывалась 0,9 % водным раствором хлорида натрия по 1 мл. Затем гомогенат фильтровался через инертный фильтр для клеток с нейлоновой сетчатой структурой и диаметром пор 20 мкм. Далее гомогенат центрифугировался для удаления надосадочной жидкости при 400 g и температуре +23 °С в течение 5 минут. Полученный образец кожи исследовался ex tempore либо после криоконсервации.
Клетки кожи инкубировались в течение 20 минут в защищенном от света месте с моноклональными антителами, конъюгироваными с флюорохромами: флюоресцеинизотиоцианатом (FITC), фикоэритрином (РЕ – Texasred (ESD)), PE/CY5(PC5), PE/CY7(PC7).
Жизнеспособность клеток определялась с помощью внутриклеточного красителя 7-amino-actinomycin D RUO (7AAD). Фенотипирование клеток проводилось на проточном цитометре Cytomics FC500 (Beckman Coulter, США) с использованием специфических маркеров: CD3, CD4, CD8, CD14, CD16, CD19, CD34, CD44, CD45, CD49, CD54, CD63, CD80, CD146, CD203c; CD207, CD249.
Идентификация выполнялась путем регистрации двух параметров: бокового светорассеяния (side scatter) и флюоресценции по 3 каналу (FL3). Для корректного исключения из зоны анализа всех частиц, которые не соответствовали по размерам и гранулярности живым клеткам, вводили необходимые логические ограничения в гистограммы распределения частиц по малоугловому, боковому светорассеянию и CD45. В каждой пробе анализировали не менее 106 клеток.
В качестве объекта исследования были выбраны клетки суспензионных культур THP-1. Культивирование клеток линии осуществляли с использованием среды RPMI-1640 («Биолот», Санкт-Петербург) с добавлением 10 % инактивированной ЭТС («Биолот», Санкт-Петербург), 50 мкг/мл гентамицина («Биолот», Санкт-Петербург) и 2 мМ L-глутамина («Биолот», Санкт-Петербург). Пересев производили каждые 2–3 дня. Для ведения клеток использовали пластиковые флаконы объемом 50 мл (Sarstedt, Германия). Клетки инкубировали при 37°С в атмосфере 5% СО2. При постановке экспериментов в лунки 96-луночного плоскодонного планшета (Sarstedt, Германия) вносили 200 мкл клеточной суспензии (2×106 клеток в мл) в соответствующей полной культуральной среде. В качестве индуктора апоптоза использовали камптотецин, основой проапоптотического действия которого является подавление активности ДНК топоизомеразы I, в финальных концентрациях 1 и 0,2 мкМ. Исследуемый активатор ксеногенного происхождения вносили в финальных концентрациях 7,70 и 350 мкМ. Также инкубацию клеток осуществляли в присутствии обоих стимуляторов. Время инкубации в присутствии стимуляторов составляло 24 часа при 37°С в атмосфере 5% СО2. Для выявления относительного содержания клеток, находящихся на разных стадиях апоптоза, применяли два флуоресцентных красителя PI и YO-PRO-1 по описанной ранее методике. При окраске клеток к 100 мкл клеточной суспензии (2–3×106 клеток/мл) добавляли раствор YO-PRO-1 (Invitrogen, США) в финальной концентрации 250 нМ и раствор йодистого пропидия (Sigma-Aldrich, США) в финальной концентрации 1 мкг/мл. Окраску проводили при комнатной температуре в течение 15 минут в защищенном от света месте. По завершении инкубации к образцам добавляли по 200 мкл ЗФР и анализировали на проточном цитометре Navios (Beckman Coulter, США). Для каждого из образцов анализировали не менее 20 000 одиночных клеток.
Концентрации камптотецина и активатора ксеногенного происхождения, использованные в эксперименте, обозначали через множества и, соответственно, каждой паре значений (xi; yi) выделяли процентные значения величины гибели клеток на ранней стадии от апоптоза (zi) и на поздней стадии – от апоптоза и некроза (z'i). Таким образом, полученные две матрицы, в которых вектор-строки (xi; yi; zi) и (xi; yi; z'i) определяют точки, лежащие на двух поверхностях в трехмерном пространстве, обрабатывались с помощью языка программирования Python Software и модулей SciPy и Numpy. На первом этапе проводилось формирование узлов двумерной сетки с помощью функции numpy.meshgrid, а затем данные интерполировались с помощью функции scipy.interpolate.griddata. Графическое построение поверхностей выполнялось с помощью модуля Matplotlib. Результаты выражали в виде процентов позитивных клеток.
Иммуногистохимические исследования проводили в парафиновых срезах с использованием соответствующих первичных антител СD4, СD8, СD14, СD68, СD204, СD163(DAKO) и системы визуализации En vision. Ядра докрашивали гематоксилином. Тепловое демаскирование антигенов проводили в микроволновой печи. Анализ проводили с помощью микроскопа Olympus–CX41 и цифровой камеры CDх41 со встроенным программным обеспечением. Пролиферативную активность клеток эпидермиса и дермы изучали с помощью моноклональных антител Ki 67 (MIB-1), идентифицирующих ядерный антиген, присутствующий у большинства пролиферативных клеток. Антиген Ki 67, определяемый соответствующими моноклональными антителами – короткоживущий протеин, разрушающийся на протяжении 1–1,5 часа, благодаря этому он выявляется только в клетках, которые делятся. Для оценки процессов апоптоза использовали моноклональные антитела к Fas-рецепторам (CD95/Apo 1).
Полученные путём биопсии образцы кожи исследовались ex tempore и после криоконсервации. Для второго варианта проверенный на стерильность образец помещался в криопробирку Costar 2 мл с раствором для замораживания (90 % Fetal Bovine Serum и 10 % DMSO в качестве криопротектора), затем образец замораживался в парах жидкого азота t° -140 °C со скоростью 1 °C в минуту методом витрификации.
В любом случае – что при первом (нативном), что при втором варианте (после размораживания) – клетки кожи инкубировались в течение 20 минут в защищенном от света месте с моноклональными антителами, конъюгироваными с флюорохромами: флюоресцеинизотиоцианатом (FITC), фикоэритрином (РЕ – Texasred (ESD)), PE/CY5(PC5), PE/CY7(PC7).
Математическую обработку цитометрических данных проводили при помощи программного обеспечения EXPO-32, CXP v. 2.2, Navios Software v.1.2 и Kaluza™ v.1.2 (Beckman Coulter, США) и Statistica 8.0 (StatSoft, США). Статистическая обработка результатов проводилась дискриптивными методами в виде средней арифметической и ее стандартной ошибки (M±m), с применением t-критерия Стьюдента для определения статистической значимости различий средних величин с нормальным распределением исходных данных. Так, t-критерий Стьюдента рассчитывался по формуле:
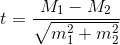
где М1 – средняя арифметическая первой сравниваемой совокупности (группы), М2 – средняя арифметическая второй сравниваемой совокупности (группы), m1 – средняя ошибка первой средней арифметической, m2 – средняя ошибка второй средней арифметической.
Полученное значение t-критерия Стьюдента интерпретировалось с учетом количества исследуемых образцов в каждой группе (n1 и n2) с определением числа степеней свободы f по следующей формуле:
f = (n1 + n2) – 2
После этого определяли критическое значение t-критерия Стьюдента для требуемого уровня значимости (например, p=0,05) и при данном числе степеней свободы f согласно общепринятой таблице степеней свободы.
Сравнивали критическое и рассчитанное значения критерия:
если рассчитанное значение t-критерия Стьюдента было равно или больше критического, найденного по таблице, делали вывод о статистической значимости различий между сравниваемыми величинами (уровень значимости р<0,05);
если значение рассчитанного t-критерия Стьюдента было меньше табличного, значит, различия сравниваемых величин статистически не были значимы.