Рузавин Г.И. в своей книге «Методология научного познания» под методом подразумевает упорядоченный и организованный способ деятельности, направленный на достижение определенной практической или теоретической цели. Изобретение метода первоначально связано с решением конкретных практических задач через выполнение ряда трудовых операций, с использованием при этом соответствующих приемов, средств или способов в строго определенном порядке [201]. Закономерности, непосредственно проверяемые экспериментом, не изменяются. Конечно, их изменение мыслимо или логически возможно, однако эта возможность не учитывается эмпирической наукой и не влияет на ее методы. Напротив, научный метод предполагает неизменность естественных процессов, или «принцип единообразия природы» [191]. Эта мысль позволяет исследователю предположить единообразие и даже параллелизм событий на разных уровнях исследования. Первый – наблюдаемый на поверхности кожи в виде клинических симптомов, другой – скрытый от глаз, но реализуемый на уровне клеток кожи и даже молекул, представленных на их поверхности.
Таким образом, для решения поставленных задач в работе использовался комплекс дополняющих друг друга методов исследования: панч-биопсии, механической гомогенизации тканей, метод проточной цитометрии, метод криоконсервации тканей, метод культивирования тканей, метод иммуногистохимии, метод концептуализации предметных областей, метод двухколенного восхождения от эмпирически конкретного к теоретически конкретному через абстрактное, метод родоструктурной экспликации понятий, методы исчисления высказываний и методы статистической обработки данных.
Отбор биоптатов кожи для экспериментального построения цитоиммунограмм проводился с использованием инструмента для панч-биопсии 2 мм. При взятии материала панч направлялся перпендикулярно поверхности кожи, с надавливанием сверху вниз и вращением его по часовой стрелке и против нее до погружения на требуемую глубину. После панч аккуратно вынимался. С помощью иглы биоптат извлекался из полости и хирургическим лезвием отсекался по нижнюю часть образца от тела пациента. На образовавшуюся ранку накладывался шов и бактерицидный пластырь.
Биоптат кожи, согласно авторской технологии, описанной в полученном патенте на изобретение «Способ получения жизнеспособной гетерогенной популяции клеток кожи» (Приложение 1), заливался 1 мл 0,9 % водного раствора хлорида натрия и помещался в рабочую камеру автоматической системы для механической гомогенизации ткани Medimachine (Becton Dickinson, США). Гомогенизация ткани проводилась в течение 30 секунд при температуре +23 °С. Гомогенат извлекался стерильным шприцем. Рабочая камера гомогенизатора трижды вымывалась 0,9 % водным раствором хлорида натрия по 1 мл. Затем гомогенат фильтровался через инертный фильтр для клеток с нейлоновой сетчатой структурой и диаметром пор 20 мкм. Далее гомогенат центрифугировался для удаления надосадочной жидкости при 400 g и температуре +23 °С в течение 5 минут [53].
Образец клеток кожи исследовался ex tempore. Клетки кожи инкубировались в течение 20 минут в защищенном от света месте с моноклональными антителами, конъюгироваными с флюорохромами: флюоресцеинизотиоцианатом (FITC), фикоэритрином (РЕ – Texasred (ESD)), PE/CY5(PC5), PE/CY7(PC7). Жизнеспособность клеток определялась с помощью внутриклеточного красителя 7-amino-actinomycin D RUO (7AAD).
Фенотипирование клеточной суспензии, приготовленной оригинальным авторским способом, описанным в полученном автором Патенте на изобретение «Способ определения субпопуляционного состава клеток кожи и получения цитоиммунограммы кожи» (Приложение 2), проводилось на проточном цитометре Cytomics FC500 (Beckman Coulter, США). Опираясь на научные факты, что кератиноциты составляют более 90 % клеток верхнего слоя кожи – эпидермис, а клетки дермы в подавляющем большинстве представлены фибробластами (фиброцитами), тучными клетками, моноцитами (макрофагами), эндотелиальными, дендритными клетками и лимфоцитами [13], из которых 90 % – Т-лимфоциты, расположенные в верхних слоях дермы и эпидермисе, а 10 % – В-лимфоциты с местонахождением в средних и глубоких слоях дермы [88], в качестве базового набора маркеров, с помощью которых идентифицировались субпопуляции клеток и определялся их фенотип, были предложены: CD3, CD4, CD8, CD14, CD16, CD19, CD34, CD44, CD45, CD49, CD54, CD63, CD80, CD146, CD203c; CD207, CD249 [49].
Идентификация выполнялась путем регистрации двух параметров: бокового светорассеяния (side scatter) и флюоресценции по 3 каналу (FL3). Для корректного исключения из зоны анализа всех частиц, которые не соответствовали по размерам и гранулярности живым клеткам, вводили необходимые логические ограничения в гистограммы распределения частиц по малоугловому, боковому светорассеянию и CD45. В каждой пробе анализировали не менее 106 клеток.
Образец клеток кожи помещался в криопробирку Costar 2 мл с раствором для замораживания (90 % Fetal Bovine Serum и 10 % DMSO в качестве криопротектора), затем образец замораживался в парах жидкого азота t° -140 °C со скоростью 1 °C в минуту методом витрификации.
Культивирование клеток суспензионных культур THP-1 осуществляли с использованием среды RPMI-1640 («Биолот», Санкт-Петербург) с добавлением 10 % инактивированной ЭТС («Биолот», Санкт-Петербург), 50 мкг/мл гентамицина («Биолот», Санкт-Петербург) и 2 мМ L-глутамина («Биолот», Санкт-Петербург). Пересев производили каждые 2–3 дня. Для ведения клеток использовали пластиковые флаконы объемом 50 мл (Sarstedt, Германия). Клетки инкубировали при 37°С в атмосфере 5% СО2. При постановке экспериментов в лунки 96-луночного плоскодонного планшета (Sarstedt, Германия) вносили 200 мкл клеточной суспензии (2×106 клеток в мл) в соответствующей полной культуральной среде.
В качестве индуктора апоптоза использовали камптотецин, основой проапоптотического действия которого является подавление активности ДНК топоизомеразы I, в финальных концентрациях 1 и 0,2 мкМ. Исследуемое биотехнологическое средство вносили в финальных концентрациях 7,70 и 350 мкМ. Также инкубацию клеток осуществляли в присутствии обоих стимуляторов. Время инкубации в присутствии стимуляторов составляло 24 часа при 37°С в атмосфере 5% СО2.
Для выявления относительного содержания клеток, находящихся на разных стадиях апоптоза, применяли два флуоресцентных красителя PI и YO-PRO-1 по описанной ранее методике [170].
При окраске клеток к 100 мкл клеточной суспензии (2–3×106 клеток/мл) добавляли раствор YO-PRO-1 (Invitrogen, США) в финальной концентрации 250 нМ и раствор йодистого пропидия (Sigma-Aldrich, США) в финальной концентрации 1 мкг/мл. Окраску проводили при комнатной температуре в течение 15 минут в защищенном от света месте. По завершении инкубации к образцам добавляли по 200 мкл ЗФР и анализировали на проточном цитометре Navios (Beckman Coulter, США).
Для каждого из образцов анализировали не менее 20 000 одиночных клеток.
Концентрации камптотецина и вещества разработанного биотехнологического средства ксеногенного происхождения, использованные в работе, обозначали через множества и, соответственно, каждой паре значений (xi; yi) выделяли процентные значения величины гибели клеток на ранней стадии от апоптоза (zi) и на поздней стадии – от апоптоза и некроза (z'i). Таким образом, полученные две матрицы, в которых вектор-строки (xi; yi; zi) и (xi; yi; z'i) определяют точки, лежащие на двух поверхностях в трехмерном пространстве, обрабатывались с помощью языка программирования Python Software и модулей SciPy и Numpy. На первом этапе проводилось формирование узлов двумерной сетки с помощью функции numpy.meshgrid [746], а затем данные интерполировались с помощью функции scipy.interpolate.griddata [548]. Графическое построение поверхностей выполнялось с помощью модуля Matplotlib. Результаты выражали в виде процентов позитивных клеток.
Математическую обработку цитометрических данных проводили при помощи программного обеспечения EXPO-32, CXP v.2.2, Navios Software v.1.2 и Kaluza™ v.1.2 (Beckman Coulter, США) и Statistica 8.0 (StatSoft, США).
Иммуногистохимическое исследование проводили в парафиновых срезах с использованием соответствующих первичных антител и системы визуализации En vision. Ядра докрашивали гематоксилином. Тепловое демаскирование антигенов проводили в микроволновой печи. Анализ проводили с помощью микроскопа Olympus CX41 и цифровой камеры CDх41 со встроенным программным обеспечением.
Пролиферативную активность клеток эпидермиса и дермы изучали с помощью моноклональных антител Ki67 (MIB-1), идентифицирующих ядерный антиген, присутствующий у большинства пролиферативных клеток. Антиген Ki67, определяемый соответствующими моноклональными антителами – короткоживущий протеин, разрушающийся на протяжении 1–1,5 часа, благодаря этому он выявляется только в клетках, которые делятся. Для оценки процессов апоптоза использовали моноклональные антитела к Fas-рецепторам (CD95/Apo 1).
Конфокальную лазерную сканирующую микроскопию in vivo выполняли с помощью конфокального лазерного сканирующего микроскопа VivaScope 1500/3000 («Lucid-Tech. Inc.», Henrietta, NY; «MAVIG GmbH», Munich, Германия).
Базовой логикой концептуальных методов является логика восхождения от наблюдаемого конкретного к мысленно абстрактному и через него – к порождению разнообразия мысленно конкретного. Это означает, что по ограниченному составу экспериментально полученных структур субпопуляций клеток может быть получено разнообразие всех теоретически возможных клеточных феноменов, что позволит выйти к теоретически полной картине состояний кожи. Такая возможность концептуализации экспериментальных результатов открывает простор научным исследованиям, существенно опережающим скорость появления новых заболеваний кожи.
Все операции над понятиями совершались в концептуальной технологии. Для этого использовались логико-математические средства: исчисление высказываний, математическая теория родов структур [29] и аппарат ступеней множеств [176]. Это позволяет методично и строго выводить все логические следствия из результатов синтеза понятий. Такими следствиями являются новые понятия, которые не были очевидны в начале концептуализации и не могли появиться в ходе поставленных экспериментов.
Статистическая обработка результатов проводилась дискриптивными методами в виде средней арифметической и ее стандартной ошибки (M±m), с применением t-критерия Стьюдента для определения статистической значимости различий средних величин с нормальным распределением исходных данных [44]. Так, t-критерий Стьюдента рассчитывался по формуле:
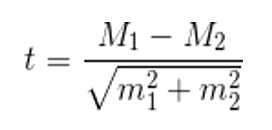
где М1 – средняя арифметическая первой сравниваемой совокупности (группы),
М2 – средняя арифметическая второй сравниваемой совокупности (группы),
m1 – средняя ошибка первой средней арифметической,
m2 – средняя ошибка второй средней арифметической.
Полученное значение t-критерия Стьюдента интерпретировалось с учетом количества исследуемых образцов в каждой группе (n1 и n2) с определением числа степеней свободы f по следующей формуле:
f = (n1 + n2) – 2
После этого определяли критическое значение t-критерия Стьюдента для требуемого уровня значимости (например, p=0,05) и при данном числе степеней свободы f согласно общепринятой таблице степеней свободы. Сравнивали критическое и рассчитанное значения критерия: