Глава содержит размышления о роли эмпирического подхода в клиническом мышлении дерматолога; сделан акцент на сложности предмета изучения – кожи человека в свете ее уникальных особенностей строения и функций. Утверждается, что известные методы исследования кожи не решают вопросов различимости состояний кожи на клеточном уровне и это не позволяет дерматологам современности в полной мере оценить функциональную активность клеточных субпопуляций кожи в условиях нормы и патологии; тем самым раскрывается существующее противоречие, препятствующее дальнейшему теоретическому и практическому развитию дерматологии; показана роль прецизионных технологий и конкретно метода проточной цитометрии как возможность преодоления противоречия. Представлено, что количественная и функциональная оценка клеток кожи открывает путь к новому пониманию и изучению процессов, происходящих в коже человека на уровне субпопуляций клеток.
Истина освободит нас, но только если мы признаем, что существует более чем один вид истины.
К. Уилбер
Тенденции развития науки наглядно демонстрируют, как ее достижения связаны с новыми технологиями исследовательской деятельности и с прогрессивными типами мышления исследователей. Последнее продиктовано высоким спросом на ускоренное появление как отдельных научных открытий и их скорейшее внедрение в практику, так и на порождение классов открытий, формирующих фронт решений актуальных проблем медицины.
Состоявшийся в 2017 г. Совет при Президенте РФ по стратегическому развитию и приоритетным проектам обозначил главные критерии результативности сферы здравоохранения – точная и быстрая диагностика, действенное лечение, доброжелательное отношение к пациенту, доступность, качество и эффективность лекарственных препаратов. Они были закреплены в Указе Президента РФ от 6 июня 2019 г. № 254 «О Стратегии развития здравоохранения в Российской Федерации на период до 2025 г.»1. Причем точная диагностика была указана приоритетно.
Вместе с тем эволюционная приспосабливаемость все чаще сменяется революционными прорывами вследствие синтеза научных знаний, и предпосылкой этому является состояние отрасли и ее специальной области – дерматологии. По своей распространенности кожные заболевания в Российской Федерации в 2016 г. входили в первую пятерку среди всех болезней. Заболеваемость болезнями кожи и подкожной клетчатки фиксировалась на достаточно высоком уровне как среди взрослого населения – каждый 25-й, так и среди детей – каждый 15-й ребенок. В абсолютных числах было зарегистрировано 8 604 183 случая заболеваний кожи и подкожной клетчатки, при этом 6 240 955 случаев заболеваний были зарегистрированы впервые2.
По прошествии пяти лет показатели распространенности и заболеваемости болезнями кожи и подкожной клетчатки оставались по-прежнему высокими3. При этом с момента публикации вышеназванного Указа прорывных технологий, результатов научного синтеза и прагматичных решений, закладывающих новизну подходов к изучению заболеваний кожи, в доступной нам литературе не встретилось. Очевидно, это следствие сложности изучения кожи человека, состоящей из колоссального количества клеток и разнообразия клеточных отношений, задействованных в патогенезах многочисленных заболеваний.
Имея документальные подтверждения в виде древнеегипетских папирусов, описывающих болезни кожи и датируемых 1552 г. до н. э., а также еще более ранние описания, встречаемые в документах шумеров за три тысячи лет до этого, можно считать дерматологию одной из древнейших медицинских наук, накопившей колоссальный объем знаний в виде атласов, руководств, методических пособий и протоколов лечения заболеваний кожи. Учеными отечественной и зарубежной школ дерматологии многое сделано для обеспечения объективных представлений о морфофункциональных особенностях кожи человека. Обладая разнообразием коопераций клеток, она функционирует в виде совокупности реакций, которые проявляются в морфологических элементах сыпи, видимых невооруженным глазом, а постановка диагнозов заболеваний кожи осуществляется по сей день путем использования стандартизированных подходов диагностики.

Доклад в рамках IV Научно-практической конференции «Никаноровские чтения» (Москва, 2018)
Опираясь на безусловную значимость богатого исторического опыта, я все же позволю себе размышления, порывающие с традицией, берущей начало со времен Гиппократа. В ней дерматология всегда рассматривалась как эмпирическая наука, основанная на систематизации наблюдаемых внешних проявлений заболеваний кожи. Традиция наблюдений, базирующаяся на практическом опыте, формировала этот опыт последовательностью субъективных заблуждений и опровержений. Каждому следующему поколению дерматологов предоставлялся (и предоставляется до сих пор) шанс самостоятельно прочувствовать все диагностические затруднения. Ориентируясь на ранее полученный кем-то опыт и соотнеся его с собственным опытом наблюдений, дерматолог вносит свой вклад в укрепление парадигмы диагностического поведения, что в совокупности не создает для дерматологии предпосылок дальнейшего развития.
Об этом хорошо написал Карл Поппер в своих рассуждениях о здравом смысле: «…Из повторяющихся наблюдений, сделанных в прошлом, мы верим, что солнце взойдет завтра, потому что оно делало это в прошлом. Считается само собой разумеющимся, что наша вера в закономерности оправдывается теми самыми многократными наблюдениями, которые привели к ее возникновению»4. Почему дерматологи-исследователи до сих пор не сомневаются в истинности суждений, основанных на эмпирическом опыте, остается загадкой.
Очевидно, что визуально состояние кожных покровов может оценить любой человек. Оценка дерматолога более точна по сравнению с обывательской, но она все же субъективна и зависит от опыта, стажа работы, количества принятых пациентов. Даже в обыденном познании при наблюдениях люди опираются на прежние мысли, опыт и обобщения. В отличие от повседневных наблюдений, которые большей частью случайны и неорганизованны, наблюдения дерматолога имеют целенаправленный характер. Они не могут являться пассивным созерцанием наблюдаемого, поскольку сознание доктора не только отражает картины мира, но и творит их, допуская ошибки, заблуждения и иллюзорные представления, направляя его тем самым по ложному пути. А убедить себя человек способен в чем угодно.
Это хорошо иллюстрирует диагностический алгоритм, используемый в дерматологии, который является не чем иным, как эмпирическим базисом, обозначающим совокупность сведений, накопленных дерматологами в процессе непосредственного взаимодействия с объектами и явлениями изучаемой предметной области – состояния кожи человека.
Симптомов заболеваний кожи реальное множество, но в расчет берется один или несколько элементов сыпи. При этом не учитывается то обстоятельство, что детерминированность происхождения элемента сыпи всякий раз различна и исходит из уникальных особенностей не только кожи, как органа, но и самого пациента. Совокупность симптомов группируется в диагноз, а точнее – диагнозы. И, метафизически удалившись от объекта дважды, дерматолог предлагает универсальное лечение, основанное на его субъективизме и эмпирическом опыте. Оправдывается все – знакомый элемент сыпи оправдывает симптом, узнаваемый симптом оправдывает диагноз, а последний через универсальность клинических рекомендаций оправдывает схему лечения.
Дерматолог не только замечает симптомы, но и сознательно отбирает из них те, которые могут подтвердить его предположение заболевания кожи. Такие предположения носят упорядоченный характер, собираясь в диагнозы. Для того чтобы каждому диагнозу сформировать конкретный образ, нужен опыт и время, и значит, дерматология в этом смысле является эмпирической наукой.
Дерматолог лечит то, что видит, а видит то, что знает.
Но основной признак науки – это способность к прогнозированию, а не передача опыта. О том, что повторяемость не имеет совершенно никакой доказательной силы, хотя и играет доминирующую роль в жизни и понимании, писал шотландский философ Дэвид Юм почти три столетия назад. Странно, что мы до сих пор не извлекли уроков.
Сегодня дерматолог знает два десятка признаков – это первичные и вторичные морфологические элементы сыпи. Их комбинация между собой и последовательная трансформация образуют диагностическое поле, выражаемое множеством диагнозов (рис. 1).
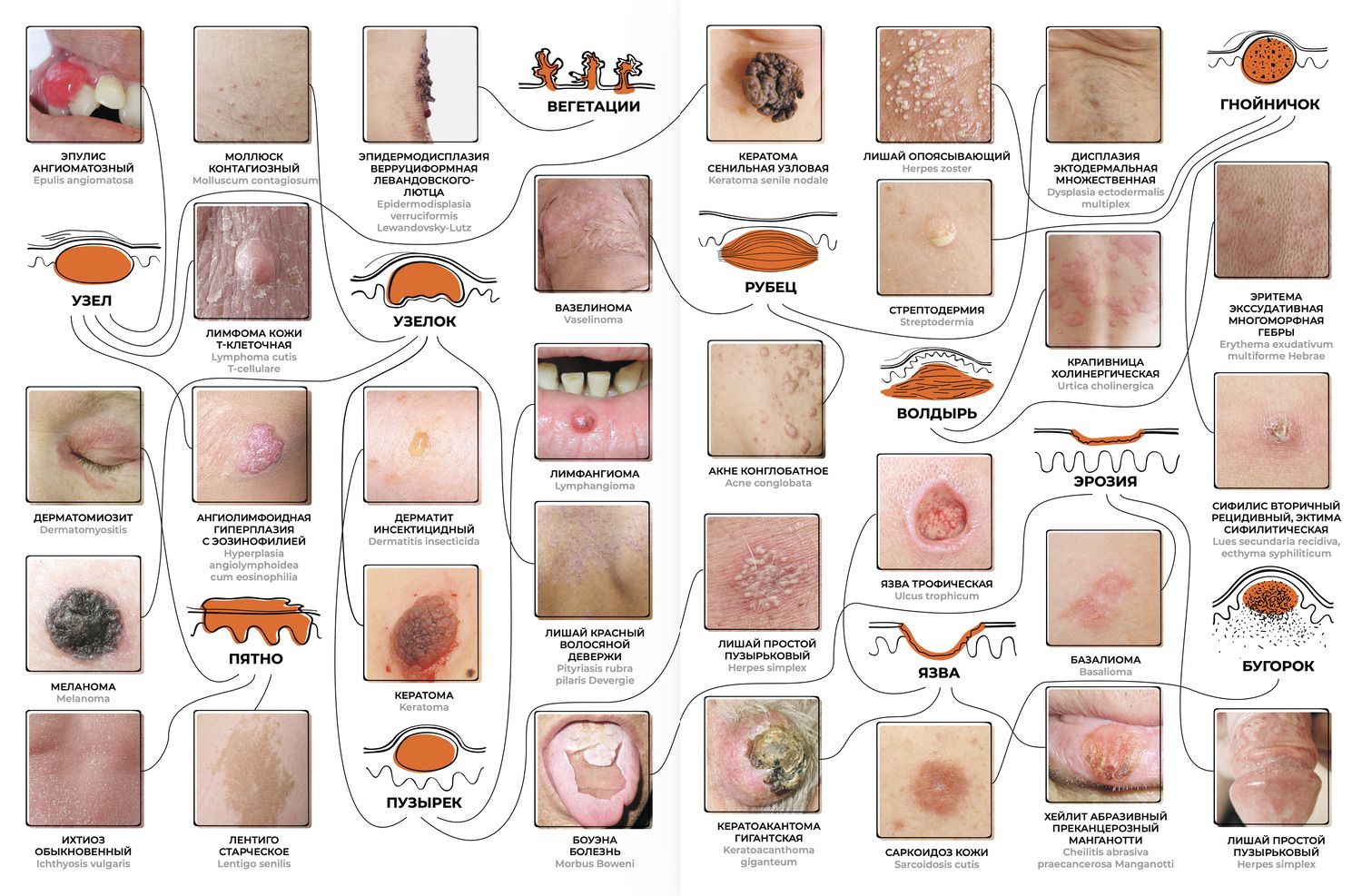
Рисунок 1. Схема мыслительной деятельности дерматолога в оценке морфологических элементов сыпи и сопоставлении с известными заболеваниями
Своей мыслительной деятельностью дерматолог стремится попасть в то место патогенеза, где сложилась наиболее высокая концентрация известных ему патогенетических проблем, а критическая масса структурных и функциональных повреждений эмпирически узнаваема. Это не оставляет шанса сойти с порочного пути проб и ошибок и выйти к прогностически результативным способам диагностики и терапии заболеваний кожи.
Так, при визуальном тестировании с просьбой предположить диагноз семь из десяти знакомых дерматологов с клиническим стажем более десяти лет не смогли даже заподозрить дерматомиозит. Хотя, казалось бы, что может быть проще? Отечные эритемы винно-красного цвета в области лица, шеи, тыла кистей, в области коленей долгое время могут быть единственными проявлениями этого заболевания. В данном случае была представлена периорбитальная очкообразная эритема, вследствие которой лицо приобрело «плаксивое» выражение, в сочетании с типичными симметричными поражениями кожи туловища и конечностей (рис. 2). Двое дерматологов предположили генерализованную форму рубромикоза, а один доктор токсикодермию.
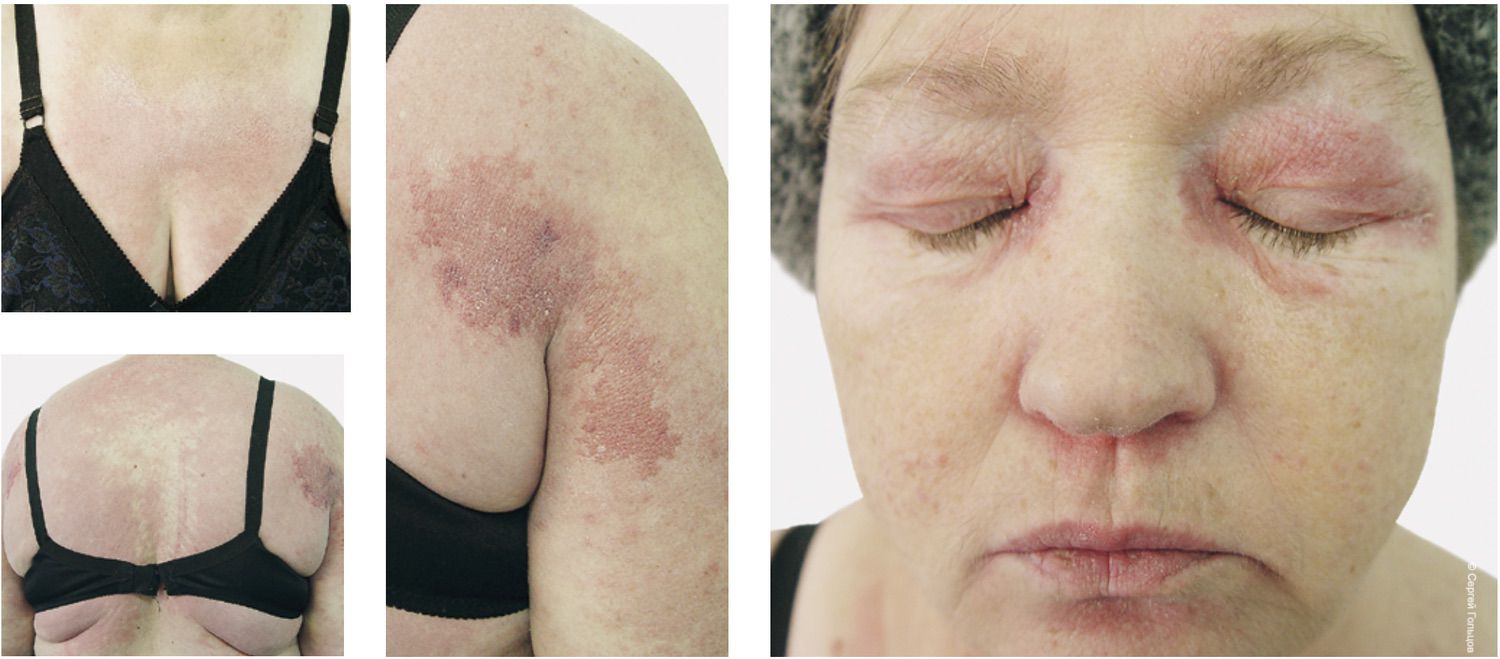
Рисунок 2. Фотографии сыпи у больной с диагнозом "дерматомиозит", примененные для тестирования дерматологов
Визуально можно предположить эти и другие диагнозы, требующие дополнительных исследований или манипуляций с элементами сыпи. Последние, призванные упорядочить диагностическое мышление дерматолога, становятся ключами, открывающими двери диагностической неопределенности.
Морфологические элементы сыпи, призванные упорядочить диагностическое мышление дерматолога, становятся ключами, открывающими двери диагностической неопределенности.
Своей простотой использования в качестве критериев первичной диагностики элементы сыпи усиливают и без того существующую потребность дерматологов в закономерностях, оправдывающих дальнейшие действия и назначение лечения в том числе. Зачастую такая зависимость заставляет находить закономерности даже там, где их нет и никогда не было (рис. 3).
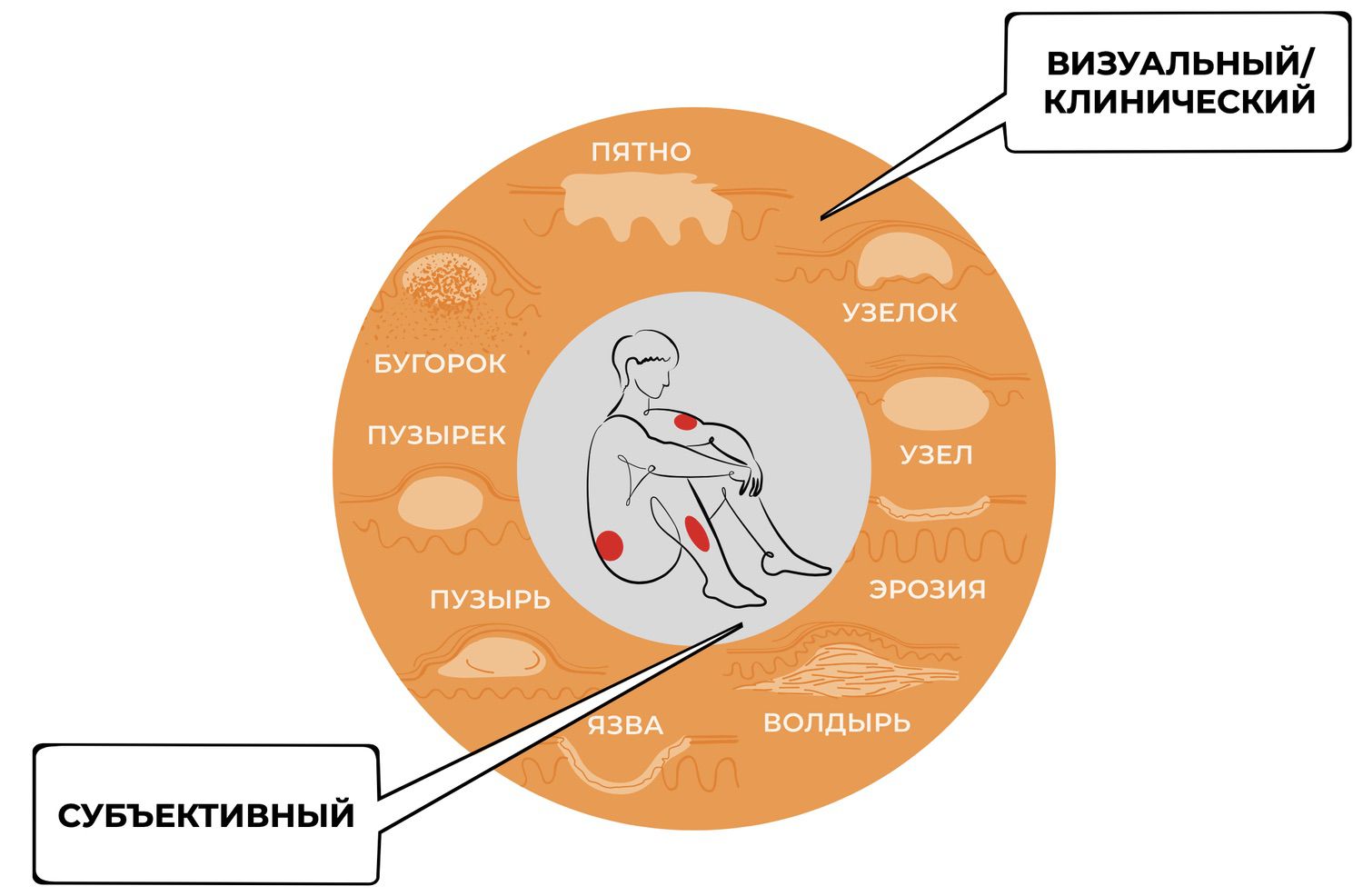
Рисунок 3. Парадокс диагностического контура
Кстати, использование медицинской лупы для осмотра элементов сыпи на протяжении нескольких столетий как раз было продиктовано потребностью доктора увидеть лучше и познать элемент сыпи тщательнее в поиске дополнительных критериев различения. Прямым следствием этого факта является использование эпилюминисцентной дерматоскопии при диагностике новообразований кожи, когда визуальная диагностика требует однозначной трактовки.
От того, что дерматология спустя тысячи лет продолжает опираться на визуальную диагностику, возникает следствие – использование средств симптоматического подхода к лечению. Дерматология движется в русле поиска однотипных лечебных средств для решения разных проблем и универсально удовлетворяющих практику.
Очевидно, это приносит улучшение показателей, но и одновременно свидетельствует о том, что сама парадигма исчерпала себя в возможности развития. В подтверждение этих слов предлагается два случая клинического наблюдения (рис. 4).
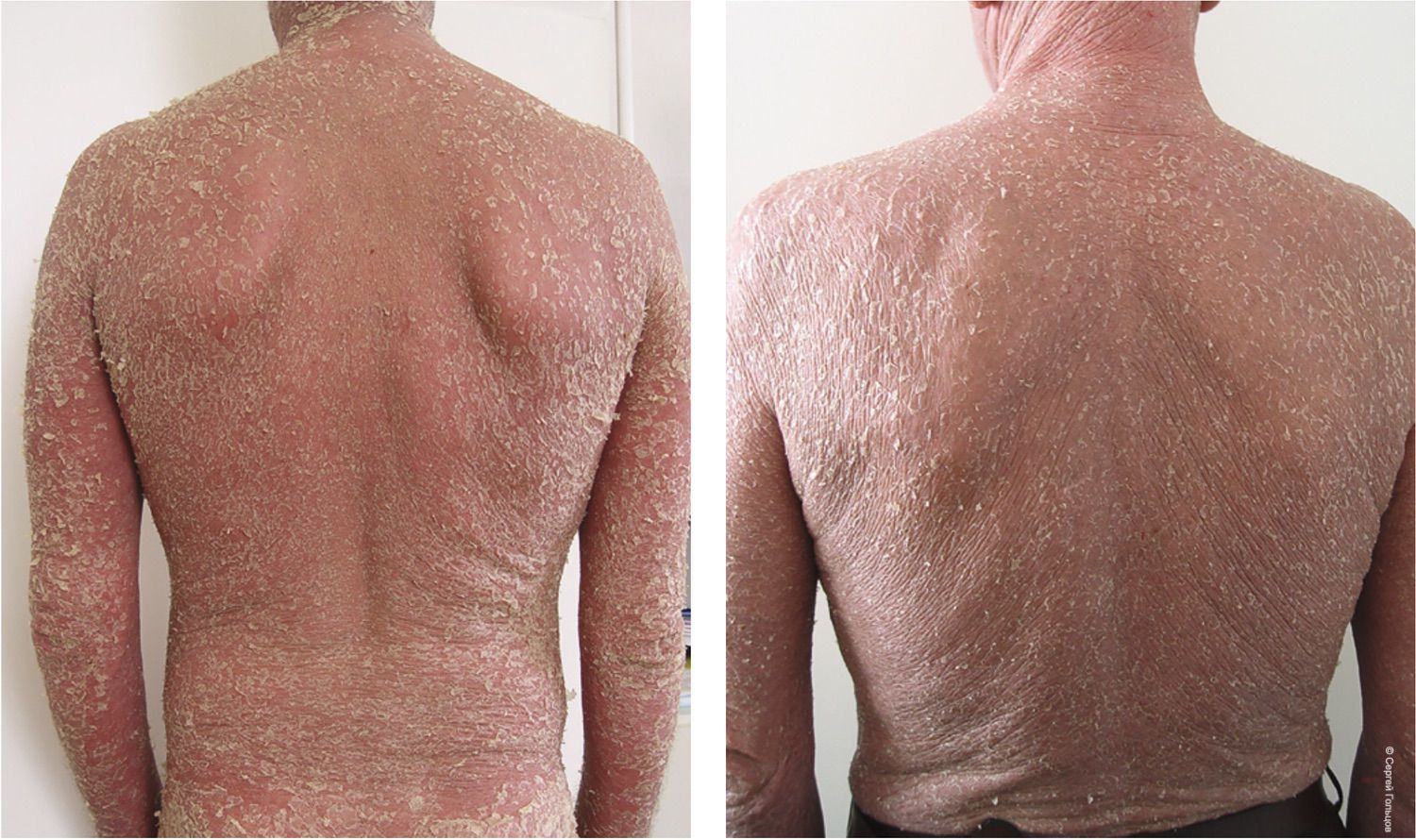
Рисунок 4. Два клинических случая. Пациент 1 (51 год) и Пациент 2 (54 года) на первичном приеме в кабинете дерматолога жалуются на высыпания на коже туловища
По плече-лопаточному сочленению видно, что это два разных человека. Визуально и анамнестически оба пациента демонстрируют сходство наблюдаемой клинической картины. Осмелившись, можно сказать, что они не различимы. Но так ли это? Одинаков ли у них диагноз?
Руководствуясь традиционной схемой постановки клинического диагноза, основанной на описании видимых глазом элементов сыпи, мы можем предположить различные диагнозы – лимфома, эритродермия, псориаз, экзема, токсикодермия… и не только эти. Подход к лечению, продиктованный клиническими рекомендациями по специальности «Дерматовенерология» за 2015 г., привел к тому, что Пациент 1 показал стремительную динамику улучшения состояния кожных покровов и через две недели был выписан из стационара в труд, в отличие от Пациента 2, который скончался спустя четыре месяца от даты постановки диагноза (рис. 5).
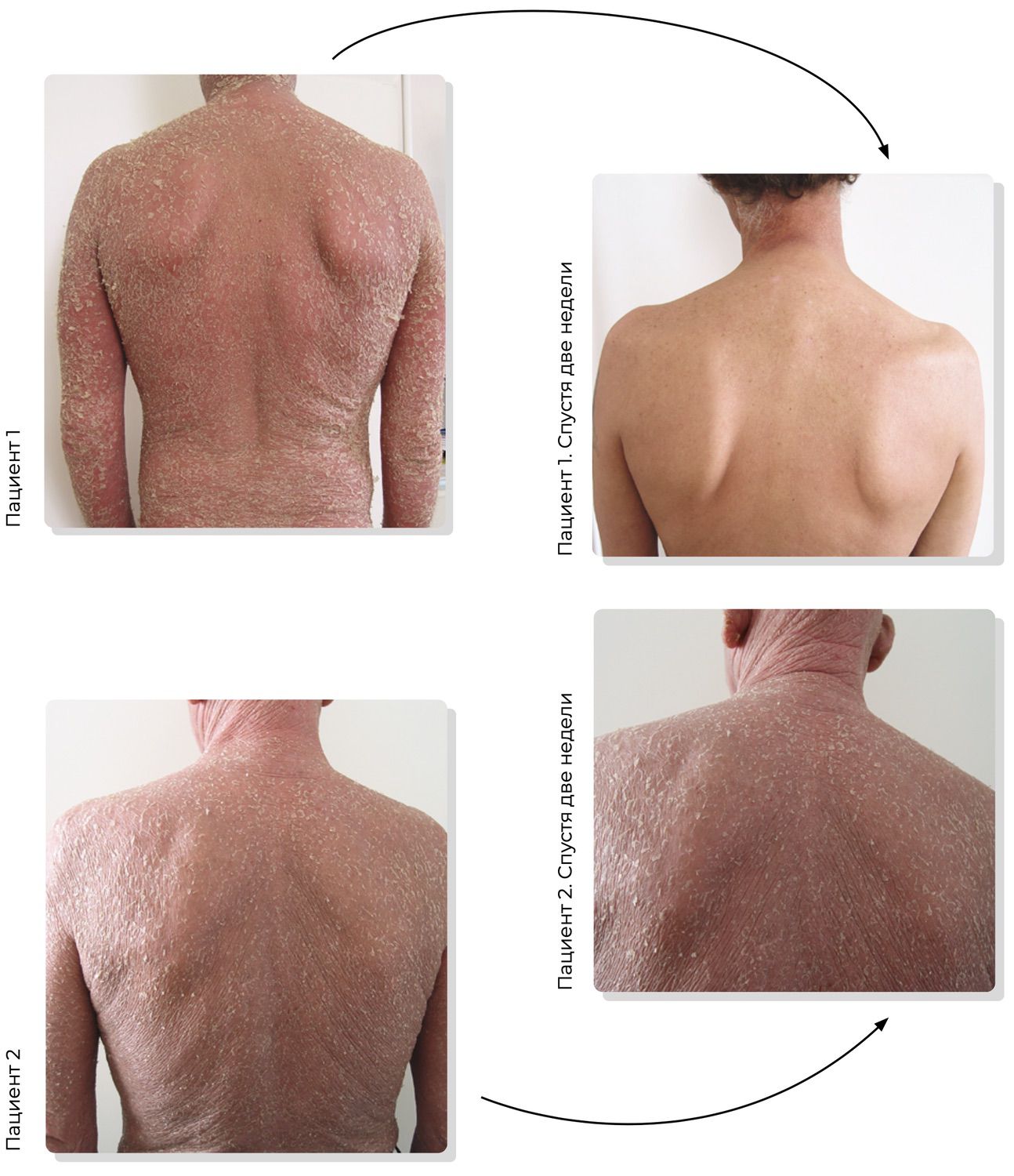
Рисунок 5. Сравнение эффективности комплексной терапии на этапе клинического диагноза
Это далеко не единственный пример, когда клинический диагноз уточняется до заключительного слишком поздно.
Дефицит патогенетических сведений о морфологических проявлениях заболеваний кожи заставляет дерматологов упрощать наблюдаемые явления до известных диагнозов, обосновывая диагностику и лечение заболеваний кожи только визуализацией последних. Зачастую при постановке диагноза дерматолог использует известные ему абстрактные понятия, отношения между которыми только приблизительно отражают связи между реально существующими клетками кожи и их функциями. Бесспорно, диагнозы имеют значение уже потому, что они относительно верно, но все же отображают свойства и отношения элементов исследуемых совокупностей. Это дает возможность описывать наблюдаемую картину и с помощью языка осуществлять накопление и передачу знаний.
Но при обсуждении видимой части воспалительных процессов и патогенетических механизмов, лежащих в основе их появления, следует рассматривать их частями единого целого. Точнее, как систему разнородных объектов, объединенных в одно целое – кожу человека. Функционально взаимодействуя друг с другом, эти части определяют все разнообразие наблюдаемых дерматологами элементов сыпи и их трансформаций.
Элементы сыпи, а также кожа в целом качественно меняют свое состояние в результате изменений, происходящих на уровне клеток и поверхностно активных молекул, выражающих функцию этих клеток. Последние, для объективности суждений о диагнозе, необходимо описывать в количественном выражении, поскольку каждая клетка кожи должна рассматриваться как отдельная целостность, состоящая не только из собственных частей, но и мембранных событий на поверхности, характерных для определенных стадий ее дифференцировки, пролиферации, активации, апоптоза и других состояний и функций.
Являя собой двухкомпонентную тканевую систему, образованную эпидермисом и дермой, кожа представлена рядом субпопуляций клеток, имеющих строгое функциональное предназначение выполняемых функций. Образуя обширную область контакта с внешней средой и представляя собой важнейшую барьерную ткань, ограничивающую внутреннюю среду организма, кожа человека исторически сформировалась в самостоятельный орган иммунной системы, который зачастую является главным плацдармом реализации большинства механизмов ее реагирования. Обладая многообразием иммунокомпетентных клеток, кооперирующихся между собой с помощью комплементарных структур на поверхности и при участии иммунорегуляторных цитокинов, кожа представляет собой активный иммунный орган, в котором резидентные и рециркулирующие клетки эпидермиса и дермы способны инициировать воспалительные процессы как всего организма, так и in situ5, сочетая черты локальности функционирования и интегрированности в общую иммунную систему организма.
Одновременно кожа находится под постоянным многоуровневым контролем иммунной системы, который, с одной стороны, направлен на создание барьера, обеспечивающего элиминацию проникающих сквозь кожу чужеродных агентов (микроорганизмы, белки, аллергены, гаптены и др.), а с другой – на поддержание гомеостаза этой ткани посредством регуляции жизнедеятельности ее клеток и большинства функций, реализуемых на уровне отдельных субпопуляций клеток и молекул. Еще в 1983 г. Д. Стрейлейну удалось сформулировать понятие «лимфоидная ткань, ассоциированная с кожей», которым он предложил обозначить компоненты иммунной системы, локализованные в эпидермисе: антигенпредставляющие клетки, Т-лимфоциты, тропные к эпидермису, кератиноциты и регионарные лимфоузлы6. Позднее это понятие было распространено на всю кожу, в которой были обнаружены факторы естественного иммунитета, а также клетки и медиаторы адаптивного иммунитета.
В основе большинства заболеваний кожи также лежит нарушение процессов как локального, так и системного компартментов иммунной системы7, при непосредственном участии клеток и цитокинов кожи8. Это приводит к многообразным иммунопатологическим реакциям и выражается в колоссальном разнообразии вариантов клинической картины заболеваний кожи9, что и создает явную познавательную сложность для дерматолога в ходе осмотра кожных покровов.
Высокая концентрация и плотность расположения в дерме клеток Лангерганса, дермальных дендритных клеток, макрофагов и субпопуляций Т-лимфоцитов, В-лимфоцитов, плазматических клеток и естественных киллеров10, а также динамика функционального состояния кожи, обеспечиваемая постоянным обновлением состава рециркулирующих лимфоцитов между регионарными лимфатическими узлами, кровью и кожей11 и создающая тем самым иммунный гомеостаз, вызывает сложность в исследовании свойств субпопуляций клеток, но одновременно и открывает возможность постижения механизмов, до сих пор учитываемых дерматологами только теоретически.
Вместе с тем развитие медицинской науки сопровождается появлением новых терминов и подходов. Так, термин «персонализированная медицина» был введен впервые в 1998 г. Медициной будущего тогда обозначилась медицина «трех П»: предиктивная, превентивная и персонализированная. Впоследствии термин был расширен до медицины «пяти П», объединяющей «три П» с партисипативной и прецизионной медициной12. Лауреат Нобелевской премии Ж. Доссе (1980), предложивший термин «предиктивная», отмечал, что главная цель медицины – предотвратить заболевания. Предиктивная медицина (от лат. predictio – предсказывать) подразумевает все виды прогнозирования развития состояния здоровья пациента или группы пациентов. Но современная диагностика настолько стремительно продвинулась в техническом оснащении, что крылатая фраза «Здоровых нет, есть недообследованные» стала реальностью. Тем не менее возможность предупредить и спрогнозировать развитие болезни приводит к существенной экономии материальных и кадровых ресурсов13.
Главная задача превентивной медицины (от лат. praeventio – предупреждаю) – профилактика наступления патологического состояния или перехода его на следующую ступень14. Максимальная персонализация всех предиктивных, превентивных и лечебных мероприятий стала возможной только на современном уровне научного прогресса, хотя еще задолго до этого персонализированная медицина обсуждалась как значимая. Матвей Мудров еще в XVIII в. ввел в практику составление истории болезни, в рамках которой настоящее заболевание рассматривалось как результат воздействия средовых и наследственных факторов.
Термин «прецизионная медицина», появившийся с развитием медико-биологических и информационных технологий15, объединил подходы классической медицины с современными подходами, основанными на генетической и молекулярной диагностике. В книге К. Кристенсена и Дж. Гроссмана «Инновационное предсказание» (2009) впервые встречается сам термин «прецизионная медицина», затем он употребляется в докладе «На пути к точной медицине» Института медицины Национальной академии наук США (2011), а в 2015 г. предлагался план «Национальной программы по точной медицине»16, где предпочтительным было изучение биологических образцов, полученных от участников исследований (добровольцев) для анализа широкого спектра заболеваний17,18. А открытие ДНК и ее функций заложило фундамент для дальнейшего развития технологий, позволяющих получить подробную информацию о структуре и функциях всех молекул клетки19.
Совершенствование системы раннего выявления заболеваний является одной из приоритетных целей государственной политики в области охраны здоровья граждан Российской Федерации, что отражено в Указе Президента РФ от 7 мая 2018 г. № 204 «О национальных целях и стратегических задачах развития Российской Федерации на период до 2024 г.», согласно которому важной задачей диагностики является выявление заболеваний на ранних стадиях процесса за счет внедрения новых диагностических технологий20.
Давно созрела необходимость разработки методов диагностики, в полной мере отвечающих рекомендациям великого русского клинициста М. Я. Мудрова, который еще два столетия назад призывал «лечить больного, а не болезнь».
Существует множество общепризнанных методов ранней диагностики заболеваний кожи. Как правило, их диагностика часто начинается с инвазивного отбора образца крови пациента из срединно-локтевой вены, с последующим анализом для выявления отклонений от нормы разных показателей крови или наличия определенных, связанных с болезнью клеток и биомаркеров. Действительно, все органы, ткани и отдельные клетки в организме человека оставляют сообщения о своем биологическом статусе и функциональном состоянии в виде молекул, поступающих в кровоток21. Однако существующие анализы крови часто не могут помочь диагностировать события на уровне клеток в воспалительном инфильтрате. Поэтому в тяжелых случаях и рефрактерных формах заболеваний можно не распознать вовремя особенности локального состояния кожи, как это было показано в представленном выше примере.
Неинвазивные методы исследования кожи – корнеометрия, себуметрия, кутометрия, профилометрия22, а для глубоких исследований – оптическая когерентная томография, ультразвуковая микроскопия, магнитно-резонансная томография23, описывая ряд свойств кожи, не дают возможности оценить сложный комплекс межклеточных взаимодействий. При всей своей убедительности в решении отдельных задач дерматологии они не позволяют получить достоверных сведений о функциональных различиях клеток кожи в количественном выражении.
Исключением является конфокальная лазерная сканирующая микроскопия, которая стала одним из наиболее распространенных методов флуоресцентной микроскопии для трехмерных структурных исследований клеток и тканей. Гибкость этого подхода позволила применить его в разнообразных исследованиях: от быстрой визуализации динамических процессов в живых клетках до тщательного морфологического анализа тканей. Являясь неинвазивной диагностикой заболеваний кожи, по разрешающей способности она приближена к патоморфологическому исследованию кожи с чувствительностью и специфичностью метода от 80 до 98,6 % и может со временем заменить гистологический метод24. Снимки конфокальной лазерной сканирующей микроскопии представляют собой полутоновые изображения и являются горизонтальными оптическими срезами (в отличие от вертикальных срезов кожи при гистологическом исследовании), что может вызывать некоторые трудности в сравнении результатов с данными, получаемыми при традиционной биопсии25. Описывая ряд свойств кожи, все перечисленные методы не позволяют получить достоверных сведений о функциональных различиях субпопуляций клеток кожи, на которую постоянно действует окружающая среда и в которой непрерывно происходит сложный комплекс межклеточных взаимодействий.
Развитие смежных с дерматологией областей медицины (иммунология, цитология) стимулирует и технологическое обновление дерматологии, которая испытывает потребность в прижизненных методах морфофункционального исследования кожи. Та или иная ограниченность использования перечисленных методов диагностики (применительно к дерматологии и прецизионной диагностике) делает актуальным поиск возможностей изучения клеток кожи, тем более что динамика увеличения разнообразия заболеваний кожи намного выше скорости активного использования новых методов диагностики.
Учитывая вышесказанное и тот факт, что кожа функционирует через специализацию субпопуляций клеток, а визуально различимые картины заболеваний кожи являются лишь следствием сложнейшего комплекса межклеточных взаимодействий, изучение образующих кожу клеток выглядит актуально и обосновано несколькими тезисами:
Предположительно, это может открыть разнообразие клинических состояний, сходных с уже известными симптомами, но имеющих существенные сведения о патогенезе на уровне клеток кожи. Им еще не придуманы имена, и, очевидно, их великое множество. Это обстоятельство создает предпосылки обращения дерматологии к цитологическому уровню исследований.
Субъективно-визуальный уровень диагностики некоторых заболеваний кожи давно испытывает потребность в сведениях на уровне клеток и молекул.
Непосредственное наблюдение мембранных событий на поверхности клеток кожи неосуществимо, но о них можно судить по показаниям проточного цитометра и допустимо считать наблюдаемыми величинами.
Проточная цитометрия – метод исследования дисперсных сред в режиме поштучного анализа элементов дисперсной фазы по сигналам светорассеивания и флуоресценции клеточных маркеров с помощью меченных флюорохромными красителями антител к поверхностным и внутриклеточным компонентам клеток26.
Как метод исследования характеристик клеток, проточная цитометрия появилась в результате синтеза знаний о гистохимических и цитохимических методах анализа. Дальнейшее развитие технологии привело к тому, что у исследователей появился в руках еще и такой инструмент, как моноклональные антитела, предоставившие возможность типировать клетки не только благодаря их морфологическим различиям, но и за счет набора поверхностных антигенов и рецепторов. Образцы клеток окрашивают флуоресцирующими моноклональными антителами и затем подвергают анализу как однородную клеточную суспензию при помощи лазера, что позволяет характеризовать клетки и дает возможность судить об их типе и функциональном состоянии по наличию того или иного набора клеточных маркеров – кластеров дифференцировки (CD). Идентификация и количественное определение отдельных клеточных субпопуляций сопровождается мультипараметрическим анализом. Размер и неоднородность внутриклеточного содержимого клетки определяются прямым и боковым светорассеянием соответственно, а измерением флуоресценции маркеров определяется фенотип клеток и их жизнеспособность (рис. 6).
Рисунок 6. Схема метода проточной цитометрии
Показания, снимаемые методом проточной цитометрии, позволяют судить о морфологических характеристиках клеток (размере, отношении размеров ядра и цитоплазмы, гранулярности цитоплазмы, степени асимметрии клеток), определять субпопуляционный состав и с высокой точностью оценивать их функциональное состояние27.
Эта технология позволяет получить ясную картину состояния и функции клеток и лучше понять механизмы клеточного ответа. Несколько существенных особенностей делают этот метод особенно ценным для исследовательской и диагностической практики:
При этом те же авторы отмечают недостаток метода проточной цитометрии – сложность пробоподготовки суспензии клеток, особенно при исследовании клеток тканей и органов.
Следует упомянуть, что процесс получения моноклональных антител был изобретен Жоржем Келером и Сезаром Мильштейном в 1975 г.29. За это изобретение в 1984 г. они получили Нобелевскую премию по физиологии. Идея состояла в том, чтобы взять линию миеломных клеток, которые потеряли способность синтезировать свои собственные антитела, и слить такую клетку с нормальным B-лимфоцитом, синтезирующим антитела, с тем чтобы после слияния отобрать образовавшиеся гибридные клетки, синтезирующие нужное антитело. Эта идея была успешно реализована, и уже к 1982 г. была предложена классификация кластеров дифференцировки – номенклатура антигенов человека для идентификации и исследования поверхностных мембранных белков, обозначающих сплайсированный вариант внеклеточного домена молекулы клеточной поверхности. CD-антигенами (или CD-маркерами) могут быть белки, которые служат рецепторами, участвующими во взаимодействии клеток между собой и являющимися компонентами каскада определенных сигнальных путей (рис. 7).
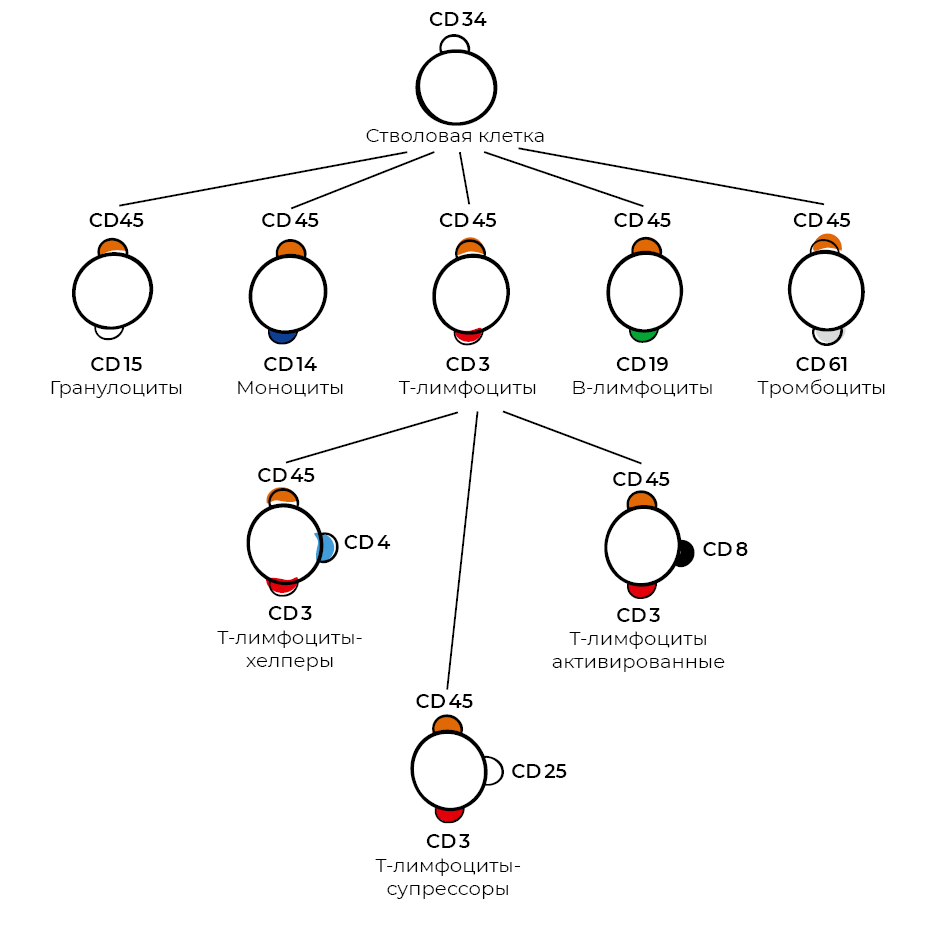
Рисунок 7. Схема дифференцировки лимфоцитов крови в зависимости от выполняемой функции
Представляющие собой интегральный инструмент определения фенотипа входящих в состав тканей клеток, в основе которого положен принцип обнаружения связи антиген – антитело, специфические антитела могут быть получены практически к любому белку (или его фрагменту). В настоящее время номенклатура CD одобрена Международным союзом иммунологических обществ и Всемирной организацией здравоохранения, актуальный список маркеров которой постоянно пополняется и уже содержит более четырехсот CD-антигенов и их подтипов30.
Способность моноклональных антител быть нацеленными на одну конкретную детерминанту клетки превращает их в высокочувствительные реагенты и позволяет анализировать субпопуляции клеток, идентифицировать их количество, измерять поверхностные и внутриклеточные маркеры, оценивая функциональное состояние и отражая его в виде гистограмм распределения (рис.8).
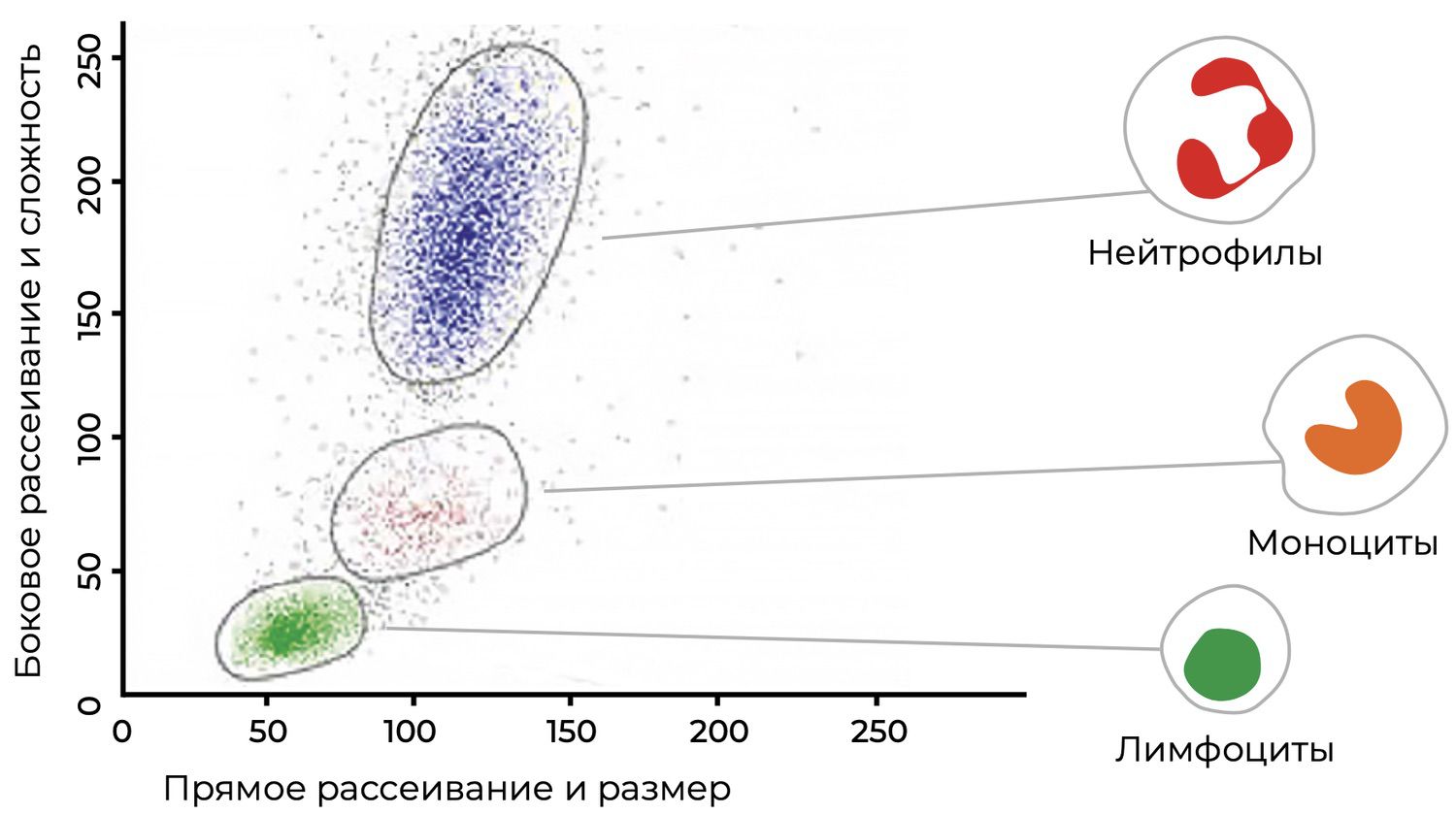
Рисунок 8. Гистограмма распределения лимфоцитов крови с использованием моноклональных антител
В этой связи метод проточной цитометрии во всем мире рекомендован для количественной и качественной оценки популяций клеток в биологических образцах пациентов и при сертификации биологических продуктов31. Почему до сих пор этому великолепному открытию не нашлось практического применения в дерматологии, остается загадкой.
Особенно это парадоксально в свете того, что проточный цитометр позволяет поштучно подсчитать клетки и экспрессируемые ими мембранные молекулы в популяции из миллионов клеток и отделить их по размеру или осуществляемой функции – активация, пролиферация и динамические изменения фенотипа со скоростью сбора информации до 1 000 событий в секунду в реальном времени, взяв всего одну пробу у пациента.
Проточная цитометрия незаменима при идентификации, характеристике и выделении клеток-предшественников, а также фиксации изменений в отдельных клетках их гетерогенных популяций и уже позволяет выявлять популяции клеток костного мозга, лимфоидной ткани и периферической крови пациентов32. Поскольку метод напрямую сопряжен с математическим анализом, с целью минимизации ошибок при планировании цитометрического иммунофенотипирования рекомендовано определение стандартных панелей антител33. Это позволяет понять роль отдельных субпопуляций клеток и их функций в патогенезе заболеваний, а также определить перспективы развития терапии. Различия в иммунофенотипах уже используются для широкомасштабных исследований клеток, выделенных из разных тканей:
Становится очевидным, что подлинное развитие дерматологии не представляется возможным в отрыве от клеточных технологий. При этом клеточные технологии способны стимулировать обновление дерматологии, что позволит досконально изучить процессы формирования разнообразия клеток кожи, их специализацию и избирательность функций, тем самым расширить познавательную активность дерматологов. В нашем случае новым уровнем считывания симптомов – клеточным, фенотипическим (рис. 9).
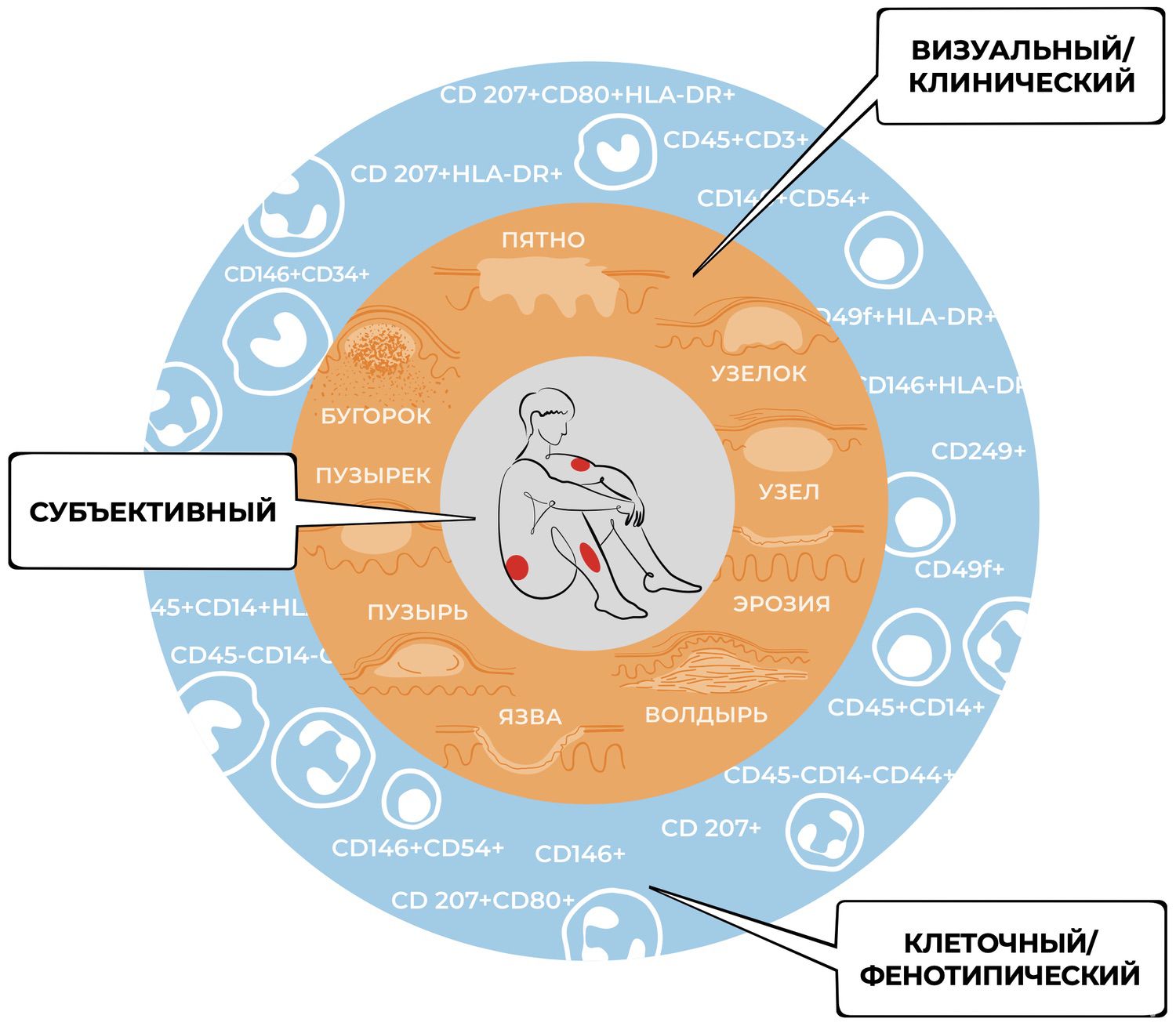
Рисунок 9. Уровни познавательной активности дерматолога
А пока дерматологи все чаще видят девальвацию терминов в контексте прогресса. Заимствуя термин из литературы, применяя его к диагностической деятельности (существенно изменившейся по отношению к той, которая была в момент описания термина) – и термин уже не объясняет наблюдаемого. Как минимум это разочаровывает в описательных свойствах термина, а как максимум направляет дерматолога по пути ложного описания наблюдаемого явления.
Переход от эмпирических понятий к абстрактным, теоретическим представляет собой диалектический скачок от чувственно-эмпирической стадии исследований к рационально-теоретической.
Поскольку относительное и абсолютное количество клеток, имеющих тот или иной фенотип, является конечным результатом иммунофенотипирования, а проточная цитометрия – основным методом иммунофенотипирования39, современная дерматология может обрести возможность идентифицировать типы клеток и их функциональное состояние по наличию того или иного набора клеточных маркеров, согласно происходящим в них процессам, и тем самым обогатить диагностический и терапевтический инструментарий новыми знаниями, каковыми она не обладала до сих пор.
[1] Указ Президента РФ от 06.06.2019 № 254 «О Стратегии развития здравоохранения в Российской Федерации на период до 2025 г.» [Электронный ресурс]. – Режим доступа: http://kremlin.ru/events/councils/by-council/1029/54079.
[2] Кубанова, А. А. Анализ состояния заболеваемости болезнями кожи и подкожной клетчатки в Российской Федерации за период 2003–2016 гг. / А. А. Кубанова, А. А. Кубанов, Л. Е. Мелехина и др. // Вестник дерматологии и венерологии. – 2017. – № 6. – С. 22–33.
[3] Кубанов, А. А. Итоги деятельности медицинских организаций, оказывающих медицинскую помощь по профилю дерматовенерология, в 2020 г.: работа в условиях пандемии / А. А. Кубанов, Е. В. Богданова // Вестник дерматологии и венерологии. – 2021. – Т. 97. – № 4. – C. 8–32.
[4] Поппер, К. Объективное знание. Эволюционный подход / К.-Р. Поппер; пер. с англ. Д. Г. Лахути; отв. ред. В. Н. Садовский. – М.: Эдиториал УРСС, 2002. – С. 38.
[5] Боровик, Т. Э. Кожа как орган иммунной системы / Т. Э. Боровик, С. Г. Макарова, С. Н. Дарчия и др. // Педиатрия. – 2010. – Т. 89. – № 2. – С. 132–136.
[6] Streilein, J. W. Skin-associated lymphoid tissues (SALT): origins and functions / J. W. Streilein // J. Invest. Dermatol. – 1983. – V. 80. – P. 12–16.
[7] Bos, J. Skin immune system: Cutaneous immunology and clinical immunodermatology / J. Bos. – 2nd ed. – CRC Press, 2004. – 412 р.
[8] Bouwstra, J. A. Structure of the skin barrier, in Skin Barrier / J. A. Bouwstra, K. Pilgrim, M. Ponec; edited by P. M. Elias, K. R. Feingold. – New York: Taylor and Francis, 2006. – 65 p.
[9] Баринов, Э. Ф. Функциональная морфология кожи: от основ гистологии к проблемам дерматологии / Э. Ф. Баринов, Р. Ф. Айзятулов, М. Э. Баринова и др. // Клиническая дерматология и венерология. – 2012. – Т. 10. – № 1. – С. 90–93.
[10] Кузьмин, Ю. А. Кожа и иммунная система (обзор литературы) / Ю. А. Кузьмин, Ж. Б. Испаева, Г. Н. Маемгенова и др. // Vestnik KazNMU. – 2019. – № 2. – С. 296–300.
[11] Белова, О. В. Иммунологическая функция кожи и нейроиммунокожная система / О. В. Белова, В. Я. Арион // Аллергология и иммунология. – 2006. – Т. 7. – № 4. – С. 492–497.
[12] Щербо, С. Н. Лабораторная диагностика как основа медицины 5п / С. Н. Щербо, Д. С. Щербо // Вестник РГМУ. – 2019. – № 1. – С. 12–14.
[13] Hayes, D. F. Personalized medicine: risk prediction, targeted therapies and mobile health technology / D. F. Hayes, H. S. Markus, R. D. Leslie, E. J. Topo // BMC Med. – 2014. – Vol. 12. – P. 37.
[14] Сучков, С. В. Персонализированная медицина как обновляемая модель национальной системы здравоохранения. Ч. 1. Стратегические аспекты инфраструктуры / С. В. Сучков, Х. Абэ, Е. Н. Антонова, П. Барах и др. // Российский вестник перинатологии и педиатрии. – 2017. – № 3 (62). – С. 7–14.
[15] Щербо, С. Н. Персонализированная медицина: Монография в 7 томах / С. Н. Щербо, Д. С. Щербо. – Т. 1. Биологические основы. – М.: РУДН, 2016. – 224 с.; Т. 2. Лабораторные технологии. – М.: РУДН, 2017. – 437 с.
[16] Juengist, E. From «Personalized» to «Precision» Medicine: The Ethical and Social Implications of Rhetorical Reform in Genomic Medicine / E. Juengist, M. L. McGowan, J. R. Fishman et al. // Hastings Center Report. – 2016. – Vol. 46 (5). – P. 21–33.
[17] Collins, F. S. New Initiative on Precision Medicine / F. S. Collins, H. A. Varmus // The New England Journal of Medicine. – 2015. – Vol. 372. – P. 793–795.
[18] Nabipour, I. Precision medicine, an approach for development of the future medicine technologies / I. Nabipour, M. Assadi // International Journal of Information Management. – 2016. – Vol. 19. – P. 167–184.
[19] Eaton, L. Human genome project completed / L. Eaton // British Medical Journal. – 2003. – Vol. 326. –№ 7394. – P. 838.
[20] Указ Президента Российской Федерации от 07.05.2018 № 204 «O национальных целях и стратегических задачах развития Российской Федерации на период до 2024 г.» [Электронный ресурс]. – Режим доступа: http://www.kremlin.ru/acts/bank/43027.
[21] Zharov, V. Revolutionising blood testing / V. Zharov // Intern. Innovatn EU. – 2010. – P. 97–99.
[22] Агафонова, С. Г. Неинвазивные методы диагностики в дерматологии и дерматокосметологии / С. Г. Агафонова, Н. И. Индилова, Е. В. Иванова и др. // Экспериментальная и клиническая дерматокосметология. – 2010. – № 4. – С. 41–45.
[23] Золотенкова, Г. В. Современные неинвазивные методы оценки возрастных изменений кожи / Г. В. Золотенкова, С. Б. Ткаченко, Ю. И. Пиголкин // Судебно-медицинская экспертиза. – 2015. – № 58 (1). – С. 26–30.
[24] Кунгуров, Н. В. Конфокальная лазерная сканирующая микроскопия: опыт работы в ГБУ СО «Уральский научно-исследовательский институт дерматовенерологии и иммунопатологии» / Н. В. Кунгуров, Н. В. Зильберберг, М. М. Кохан, Е. П. Топычканова, И. А. Куклин, Е. В. Никитина, Е. В. Бакуров // Клиническая дерматология и венерология. – 2022. – № 21 (1). – C. 106–113.
[25] Потекаев, Н. Н. Конфокальная лазерная сканирующая микроскопия на примере Vivascope 1500: принцип работы и возможности применения в дерматологии / Н. Н. Потекаев, С. Б. Ткаченко, А. Ю. Овчинникова, Н. Н. Лукашева // Российский медицинский форум: Научный альманах. – 2008. – № 1. – C. 36–41.
[26] Vembadi, A. Cell Cytometry: Review and Perspective on Biotechnological Advances / A. Vembadi, A. Menachery, M. A. Qasaimeh // Frontiers in Bioengineering and Biotechnology. – 2019. – Т. 7. – Р. 147.
[27] Хайдуков, С. В. Подходы к стандартизации метода проточной цитометрии для иммунофенотипирования. Настройка цитометров и подготовка протоколов для анализа / С. В. Хайдуков // Медицинская иммунология. – 2007. – Т. 9. – № 6. – С. 569–574.
[28] Трусов, Г. А. Применение проточной цитометрии для оценки качества биомедицинских клеточных продуктов / Г. А. Трусов, А. А. Чапленко, И. С. Семенова и др. // БИОпрепараты. Профилактика, диагностика, лечение. – 2018. – № 18 (1). – С. 16–24.
[29] Kohler, G. Continuous cultures of fused cells secreting antibody of predefined specificity / G. Kohler, C. Milstein // Nature. – 1975. – Т. 256. – Р. 495–497.
[30] Posner, J. Monoclonal Antibodies: Past, Present and Future / J. Posner, P. Barrington, T. Brier // Handbook of experimental pharmacology. – 2019. – Т. 260. – Р. 81–141.
[31]European Pharmacopoeia: EDQM. – 8th ed. [Электронный ресурс]. – Режим доступа: http://online.edqm.eu/entry.htm.
[32] Donnenberg, V. S. Cytometry in Stem Cell Research and Therapy / V. S. Donnenberg, H. Ulrich, A. Tarnok // Cytometry, Part A. – 2013. – Т. 83 (1). – Р. 1–4.
[33] O'Neill, K. Flow Cytometry Bioinformatics / K. O'Neill, N. Aghaeepour, J. Spidlen et al. // PLoS Computational Biology. – 2013. – Т. 9 (12). – e1003365.
[34] Moretti, P. Mesenchymal Stromal Cells Derived from Human Umbilical Cord Tissues: Primitive Cells with Potential for Clinical and Tissue Engineering Applications / P. Moretti, T. Hatlapatka, D. Marten et al. // Advances in Biochemical Engineering/Biotechnology. – 2010. – Т. 123. – Р. 29–54.
[35] Домнина, А. П. Мезенхимальные стволовые клетки эндометрия человека при длительном культивировании не подвергаются спонтанной трансформации / А. П. Домнина, И. И. Фридлянская, В. И. Земелько и др. // Цитология. – 2013. – № 55 (1). – С. 69–74.
[36] Шаманская, Т. В. Культивирование мезенхимальных стволовых клеток ex vivo в различных питательных средах (обзор литературы и собственный опыт) / Т. В. Шаманская, Е. Ю. Осипова, Б. Б. Пурбуева и др. // Онкогематология. – 2010. – № 3. – С. 65–71.
[37] Boxall, S. A. Markers for Characterization of Bone Marrow Multipotential Stromal Cells / S. A. Boxall, E. Jones. – Stem Cells International, 2012 [Электронный ресурс]. – Режим доступа: https://www.hindawi.com/ journals/sci/2012/975871/cta.
[38]Американская коллекция типовых культур (ATCC) [Электронный ресурс]. – Режим доступа: http://www.lgcstandards-atcc.org.
[39] Vembadi, A. Cell Cytometry: Review and Perspective on Biotechnological Advances / A. Vembadi, A. Menachery, M. A. Qasaimeh // Frontiers in Bioengineering and Biotechnology. – 2019. – Т. 7. – Р. 147.
к предыдущей странице | читать далее | сразу к следующей главе