Глава демонстрирует примеры прагматичного применения открывшихся возможностей. На этом основании подтверждается необходимость глубоких изменений в диагностических и терапевтических подходах в дерматологии как научной дисциплине, так и практике.
Подлинная философия должна быть практичной.
А. Теслинов
Научная деятельность через методологию познания рассматривает реальную картину мира и служит основным способом трансформации научного знания в практику. Реализуется это посредством изобретения методов научного исследования и их применения.
Выбор маркеров, дифференцирующих субпопуляции клеток и характеризующих динамику мембранных событий этих субпопуляций, позволил получить ряд оценок количественного и функционального характера клеток кожи у добровольцев, принявших участие в исследовании.
После пробоподготовки, описанной выше, у добровольца А. 42 лет методом проточной цитометрии определяли количество жизнеспособных клеток кожи (рис. 36). Результат составил 94 %.
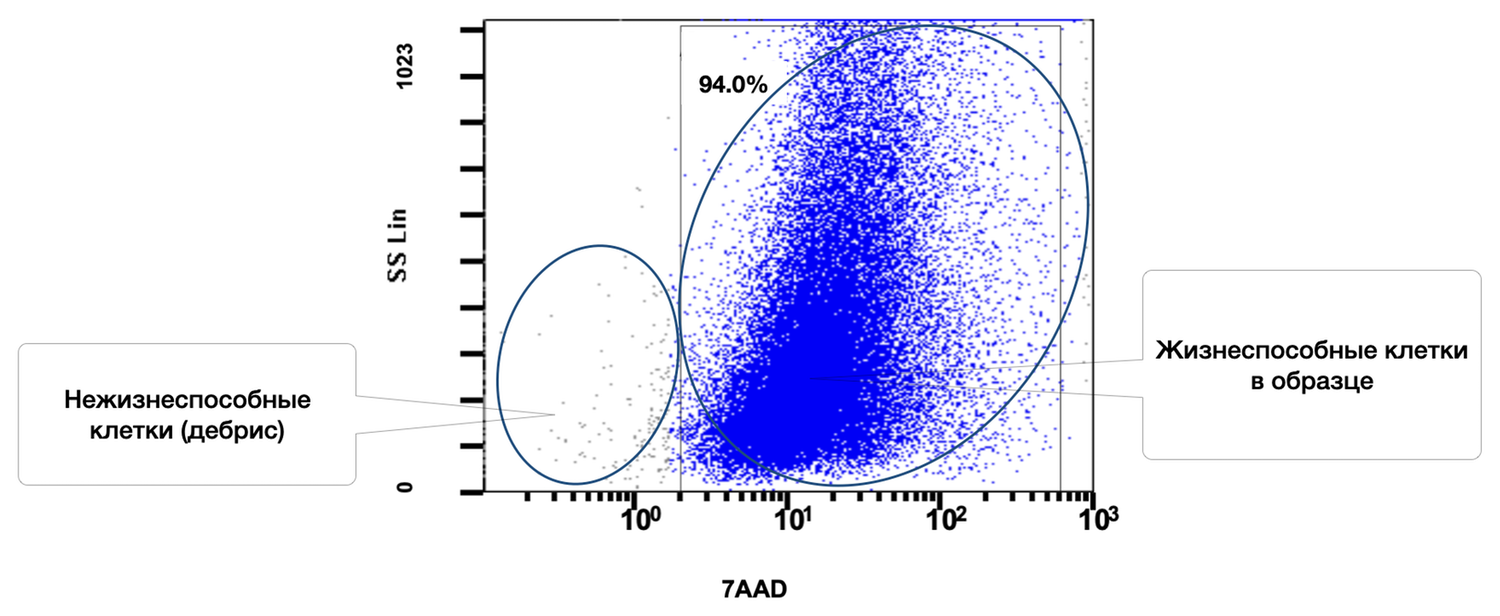
Рисунок 36. Относительное количество всех жизнеспособных (7AAD) клеток в суспензии образца кожи, выявленное методом проточной цитометрии
Ось X — 7AAD (логарифмическая шкала). Чем выше значение, тем более проницаема мембрана клетки для красителя → клетка нежизнеспособна.
Ось Y — SS Lin. Отражает гранулярность, сложность внутренней структуры клетки.
Выделенные популяции:
Жизнеспособные клетки (справа, 94.0%)
Описание: Клетки с интактной мембраной, не окрашенные 7AAD (низкий флуоресцентный сигнал по оси X).
Параметры: Ярко-синее облако клеток с выраженной гетерогенностью по SS Lin (освещает разнообразие клеточных типов).
Заключение: Основная масса клеток в образце жизнеспособна.
Нежизнеспособные клетки / клеточный дебрис (слева)
Описание: Клетки с повреждённой мембраной или клеточные обломки, интенсивно окрашенные 7AAD.
Параметры: Расположены в левой нижней части диаграммы с низкими значениями по обеим осям (низкая гранулярность и высокая проницаемость мембран).
Таким образом, общий процент жизнеспособных клеток в образце: 94.0%.
Это указывает на высокое качество образца, его пригодность для дальнейшего фенотипирования, анализа популяций (кератиноциты, фибробласты и др.), либо клеточной терапии.
Низкая доля дебриса свидетельствует о корректной подготовке материала и мягком выделении клеток.
Также регистрировали количество клеток определенных фенотипов, используя наборы моноклональных антител, меченые флюорохромами и связывающиеся с определенными рецепторами на мембранах клеток. Отмечено в образце 54,2 % кератиноцитов, из них в состоянии активности 41,4 % (рис. 37).
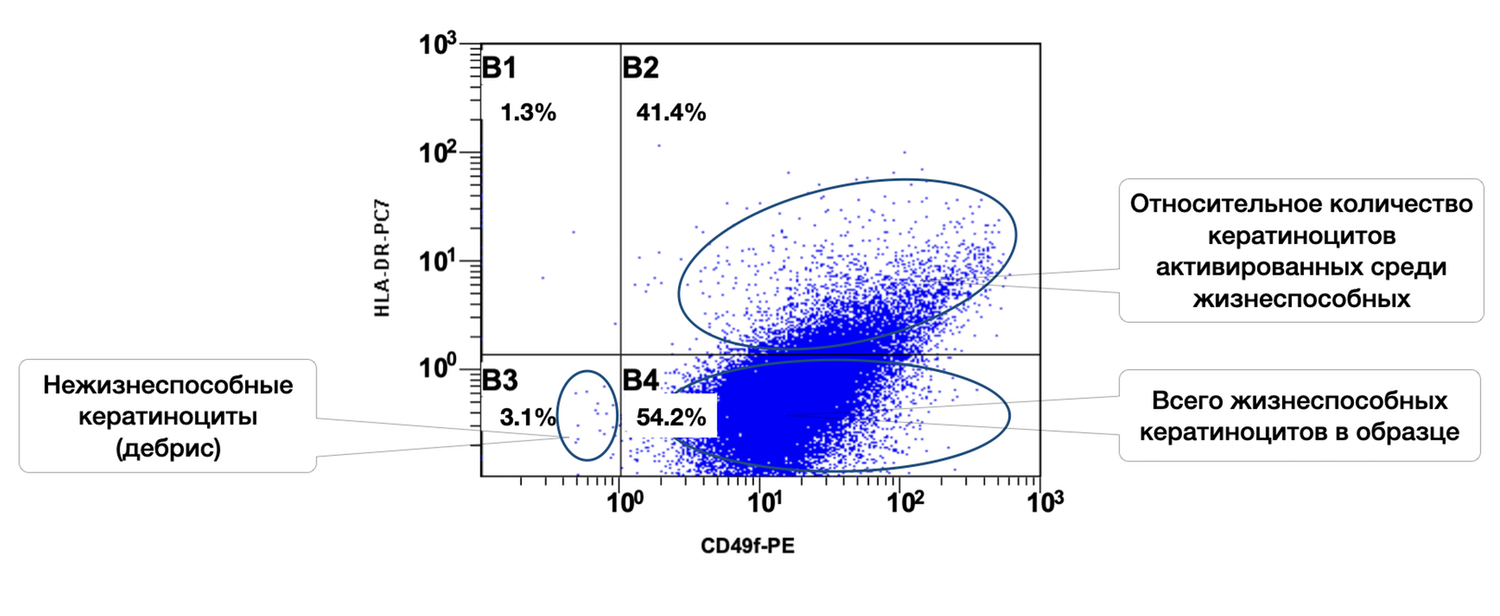
Рисунок 37. Соотношение относительного количества жизнеспособных кератиноцитов (фенотип CD49f+) и их активированных форм (фенотип CD49f+ HLA-DR+) в суспензии клеток биоптата кожи человека
Ось X — CD49f-PE. Маркер стволовых и зрелых базальных кератиноцитов (адгезионный интегрин α6β1). Повышенная экспрессия определяет активность кератиноцитарного фенотипа.
Ось Y — HLA-DR-PC7. Маркер активации иммунного ответа. В норме не экспрессируется кератиноцитами; появляется при воспалении, повреждении или стимуляции.
Области диаграммы и популяции:
|
Область |
Маркеры |
Интерпретация |
Процент |
|---|---|---|---|
|
B1 |
CD49f⁻ / HLA-DR⁺ |
Клетки, не относящиеся к кератиноцитам, но с высокой активацией |
1.3% |
|
B2 |
CD49f⁺ / HLA-DR⁺ |
Активированные кератиноциты |
41.4% |
|
B3 |
CD49f⁻ / HLA-DR⁻ |
Нежизнеспособные клетки (дебрис, фрагменты) |
3.1% |
|
B4 |
CD49f⁺ / HLA-DR⁻ |
Жизнеспособные неактивированные кератиноциты |
54.2% |
Интерпретация:
Суммарное количество жизнеспособных кератиноцитов (CD49f⁺): 95.6% (B2 + B4 = 41.4% + 54.2%) → Очень высокая доля эпидермальных клеток в биоптате — отличное качество материала.
Уровень активации среди жизнеспособных кератиноцитов: 43.3% (41.4 / (41.4 + 54.2)) → Значительная доля клеток находится в активированном состоянии, что может быть связано с воспалительным процессом, репарацией, воздействием препарата или стимуляции in vitro.
Нежизнеспособные клетки (дебрис) всего 3.1%, что подтверждает высокую жизнеспособность клеточной суспензии и корректное выделение клеток.
Таким образом, высокая доля CD49f⁺ клеток подтверждает, что в образце преобладают эпидермальные кератиноциты, а высокий процент HLA-DR⁺ среди них указывает на выраженную функциональную активность популяции, характерную для: процессов регенерации кожи, действия иммуномодуляторов или раздражающих факторов, ранних фаз заживления ран или воспалительного состояния.
Кроме того, в данном образце кожи среди 86 % жизнеспособных фибробластов 6,2 % в состоянии активности (рис. 38 и 39).
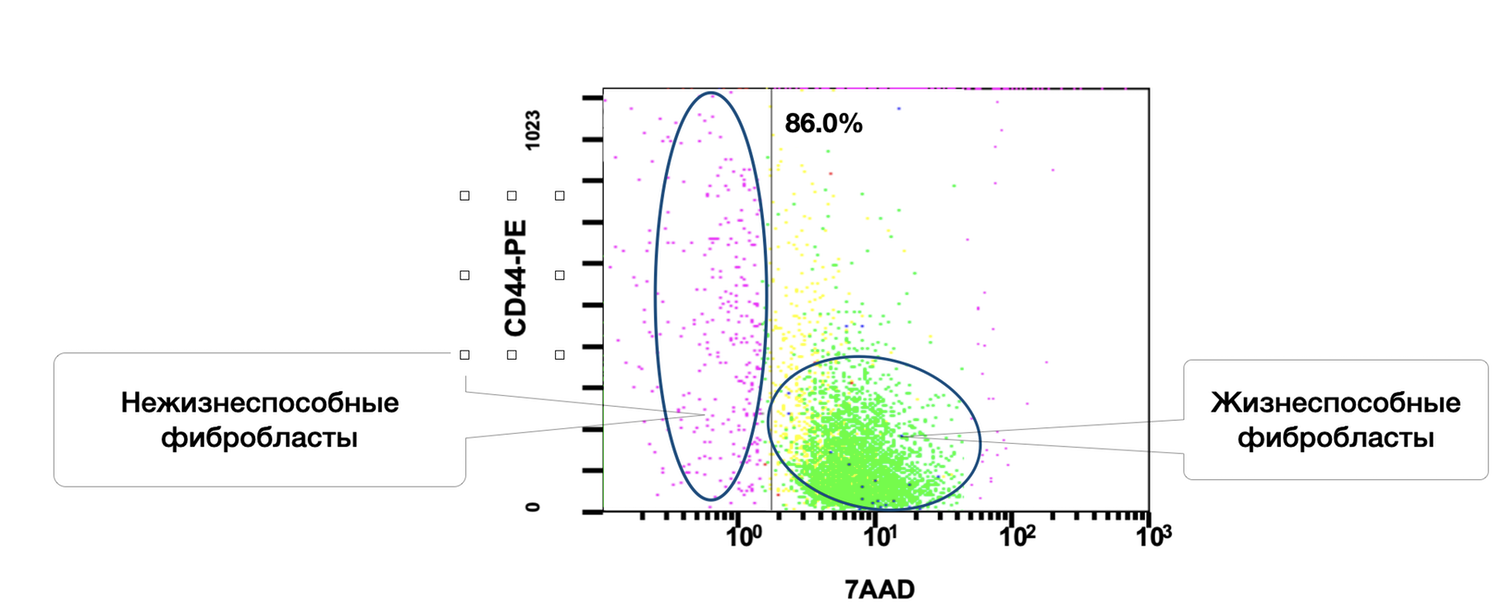
Рисунок 38. Относительное количество жизнеспособных (7AAD) фибробластов (фенотип CD45– CD14– CD44+) в суспензии клеток биоптата кожи человека
Описывая цитоиммунограмму, отображающую жизнеспособность фибробластов в клеточной суспензии (рис. 38), выделенной из биоптата кожи человека с целью определить долю жизнеспособных дермальных фибробластов (CD44⁺ CD45⁻ CD14⁻) среди всех событий в образце клеточной суспензии на основе экспрессии 7AAD — маркера жизнеспособности, можно отметить ключевые моменты.
Ось X — 7AAD (жизнеспособность). Интеркалирующий флуоресцентный краситель, проникающий только в клетки с нарушенной мембраной, его:
Низкая экспрессия определяет жизнеспособные клетки,
Высокая экспрессия определяет нежизнеспособные клетки.
Ось Y — CD44-PE (фибробластный маркер). Поверхностный гликопротеин, характерный для дермальных фибробластов и клеток мезенхимального происхождения. В сочетании с исключением CD45 и CD14 (лимфоциты/моноциты) позволяет точно идентифицировать популяцию фибробластов.
Выделенные популяции:
|
Зона |
Маркеры |
Биологическое значение |
Цвет точек |
Процент |
|---|---|---|---|---|
|
Левая область |
CD44⁺ / 7AAD⁺ |
Нежизнеспособные фибробласты |
Фиолетовый/жёлтый |
— |
|
Правая область |
CD44⁺ / 7AAD⁻ |
Жизнеспособные фибробласты |
Зелёный |
86.0% |
Интерпретация:
Высокая доля жизнеспособных фибробластов (86%) говорит о следующем:
хорошем качестве выделенного образца,
низком уровне цитотоксического повреждения при обработке биоптата,
пригодности клеточной суспензии для дальнейших in vitro / ex vivo процедур (например, стимуляция, культура, функциональный анализ).
CD44⁺ фенотип — подтверждение, что популяция действительно представлена фибробластами, при условии исключения CD45 и CD14.
Количественный состав остаточной популяции нежизнеспособных фибробластов (левый кластер) не превышает критического порога, и её наличие не мешает последующему анализу.
Таким образом, данная цитоиммунограмма дополняет предыдущие сведения о жизнеспособности кератиноцитов и позволяет судить о качестве как эпидермального, так и дермального компонентов клеточной суспензии кожи. Это важно, если исследование связано с оценкой восстановительного потенциала кожи, воспалительных процессов, воздействием препаратов, либо при подготовке клеточной массы к культивированию.
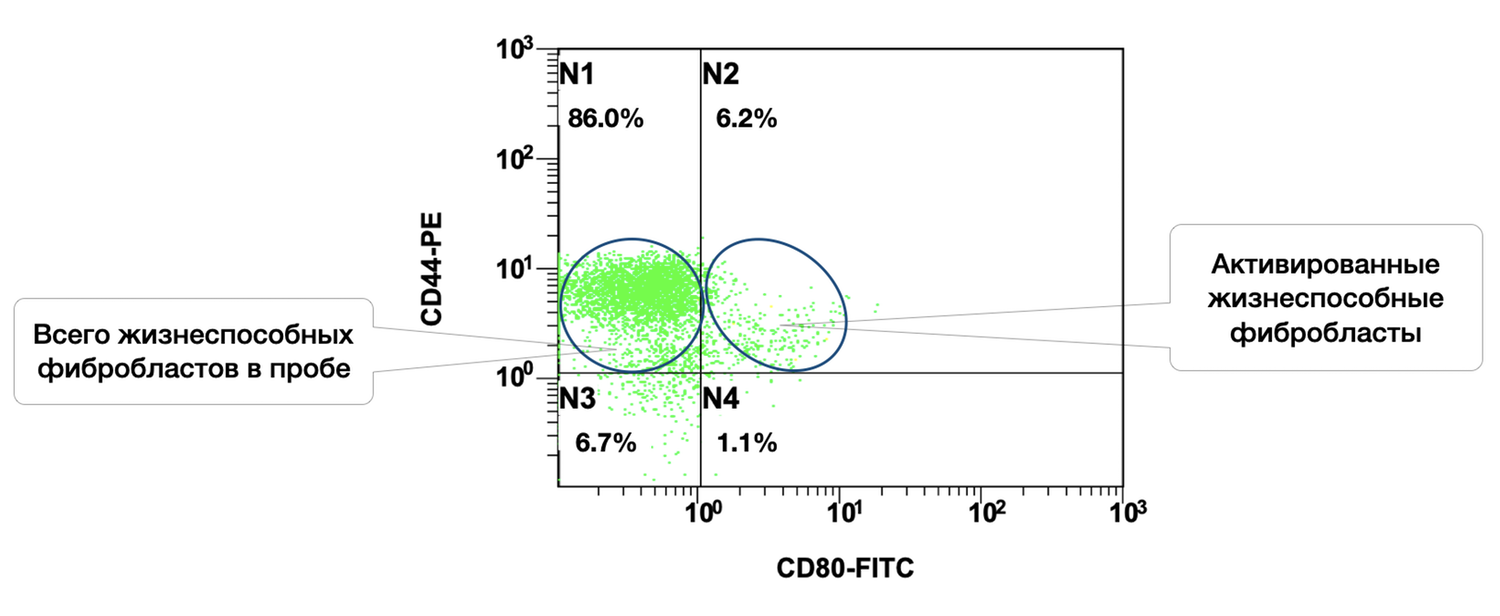
Рисунок 39. Соотношение относительного количества жизнеспособных фибробластов (фенотип CD45f– CD14– CD44+) и их активированных форм (фенотип CD45f– CD14– CD44+ CD80+) в суспензии клеток биоптата кожи человека
Цитоиммунограмма (рис. 39) отражает соотношение жизнеспособных и активированных фибробластов в клеточной суспензии, полученной из биоптата кожи человека. Это позволяет определить, какая доля жизнеспособных дермальных фибробластов (CD44⁺ CD45⁻ CD14⁻) проявляет признаки функциональной активации, то есть экспрессирует молекулу ко-стимуляции CD80.
Ось X — CD80-FITC. Молекула CD80 является маркером активации, особенно в контексте презентации антигенов и клеточной коммуникации:
CD80⁻ определяет неактивные фибробласты,
CD80⁺ определяет активированные фибробласты.
Ось Y — CD44-PE. Поверхностный маркер дермальных фибробластов. В сочетании с исключением CD45 и CD14 позволяет выделить чистую популяцию фибробластов кожи.
Выделенные популяции:
|
Квадрант |
Маркеры |
Биологическое значение |
Цвет точек |
Процент |
|---|---|---|---|---|
|
N1 |
CD44⁺ CD80⁻ |
Жизнеспособные неактивированные фибробласты |
Зелёный |
86.0% |
|
N2 |
CD44⁺ CD80⁺ |
Активированные жизнеспособные фибробласты |
Зелёный |
6.2% |
|
N3 |
CD44⁻ CD80⁻ |
Остаточные клетки, вероятно не фибробласты |
— |
6.7% |
|
N4 |
CD44⁻ CD80⁺ |
Несущественные, возможно артефакты / шум |
— |
1.1% |
Интерпретация:
Общая доля жизнеспособных фибробластов в пробе (CD44⁺): 92.2% (N1 + N2), что подтверждает высокое качество клеточной массы.
Доля активированных жизнеспособных фибробластов (CD44⁺ CD80⁺): 6.2%, что говорит о наличии локального или индуцированного клеточного ответа, вероятном участии фибробластов в иммуномодуляции и регуляции заживления, возможности воздействия внешнего стимула (например, воспаление, препарат, УФ-воздействие).
Основная часть фибробластов находится в неактивированном состоянии (86%), что может соответствовать состоянию кожи в норме или после разрешения воспаления.
CD80⁺ фибробласты обладают иммунной активностью, способной взаимодействовать с клетками врождённого и адаптивного иммунитета. В контексте фенотипической дерматологии это может быть признаком:
реакции на повреждение или стресс,
начала ремоделирования кожи,
участия фибробластов в презентации антигенов.
Таким образом, цитоиммунограмме дополняет ранее представленные данные о жизнеспособности клеток и демонстрирует, что даже при высокой доле жизнеспособных фибробластов, только ограниченная их часть активирована. Это может быть значимо для оценки эффективности терапии, степени воспаления, регенеративного потенциала дермы.
В этом же образце кожи 78,5 % жизнеспособных тучных клеток среди всех тучных клеток в пробе, но из них в состоянии активности только 1,1 % (рис. 40 и 41).
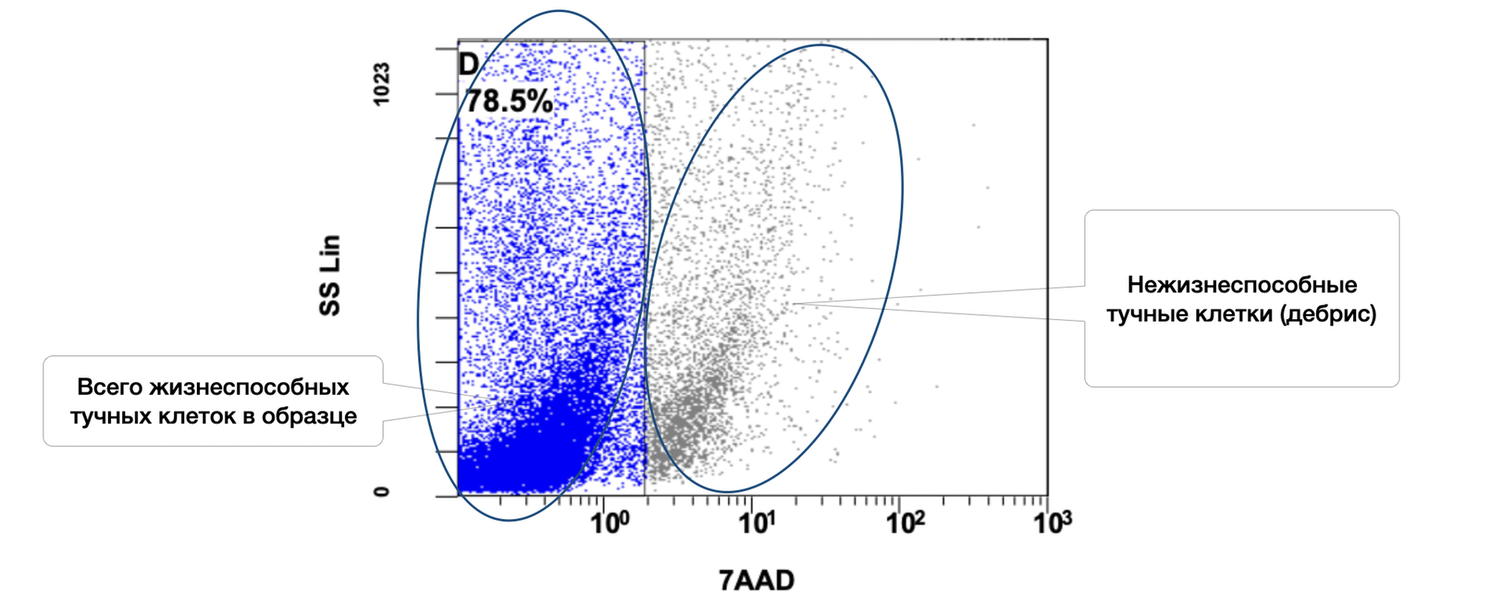
Рисунок 40. Относительное количество жизнеспособных (7AAD) тучных клеток (фенотип CD249+) в суспензии клеток биоптата кожи человека
Цитоиммунограмма (рис. 40), иллюстрирует оценку жизнеспособности тучных клеток в клеточной суспензии, полученной из кожного биоптата, позволяя оценить долю жизнеспособных тучных клеток (CD249⁺, также известен как c-Kit/SCFR) в общем клеточном пуле биоптата кожи, используя краситель жизнеспособности 7AAD (отмечает нежизнеспособные клетки).
Ось X — 7AAD. Является маркером апоптоза и гибели клеток:
7AAD⁻ определяет жизнеспособные клетки
7AAD⁺ определяет нежизнеспособные (дебрис, фрагменты клеток)
Ось Y — SS Lin (боковое рассеяние света). Отражает гранулярность и сложность клеток — у тучных клеток она обычно высокая (высокий SS-сигнал).
Выделенные популяции:
|
Область |
Характеристика |
Цвет точек |
Процент |
|---|---|---|---|
|
D (слева, синий кластер) |
Жизнеспособные тучные клетки (CD249⁺, 7AAD⁻) |
Синий |
78.5% |
|
Справа (серый кластер) |
Нежизнеспособные тучные клетки (CD249⁺, 7AAD⁺) |
Серый |
~21.5% |
Интерпретация:
Общая доля жизнеспособных тучных клеток в образце составляет 78.5%, что говорит о:
хорошем качестве пробы,
приемлемых условиях забора и хранения биоптата,
высокой функциональной пригодности материала для последующего анализа (например, оценки дегрануляции, маркеров активации и т.д.).
Оставшиеся ~21.5% клеток — нежизнеспособны, возможно, вследствие деградации, механического повреждения или поздней стадии активации (ауторазрушение).
Тучные клетки — ключевые медиаторы кожного иммунного ответа: участвуют в ранних этапах воспаления, содержат гистамин, триптазу, хемокины, играют роль в ангиогенезе и заживлении. Высокая жизнеспособность подтверждает, что в данной пробе:
присутствует сохранённый пул функциональных тучных клеток,
возможна их последующая активация или исследование их фенотипа (например, CD107a и др.),
может быть оценено участие в иммунопатогенезе или заживлении кожи.
Таким образом, данная цитоиммунограмма завершает комплексную фенотипическую оценку клеточного состава кожного биоптата. Вместе с фибробластами и кератиноцитами, жизнеспособные тучные клетки составляют ещё один важный компонент, который может быть вовлечён в воспалительные, аллергические или регенеративные процессы кожи.
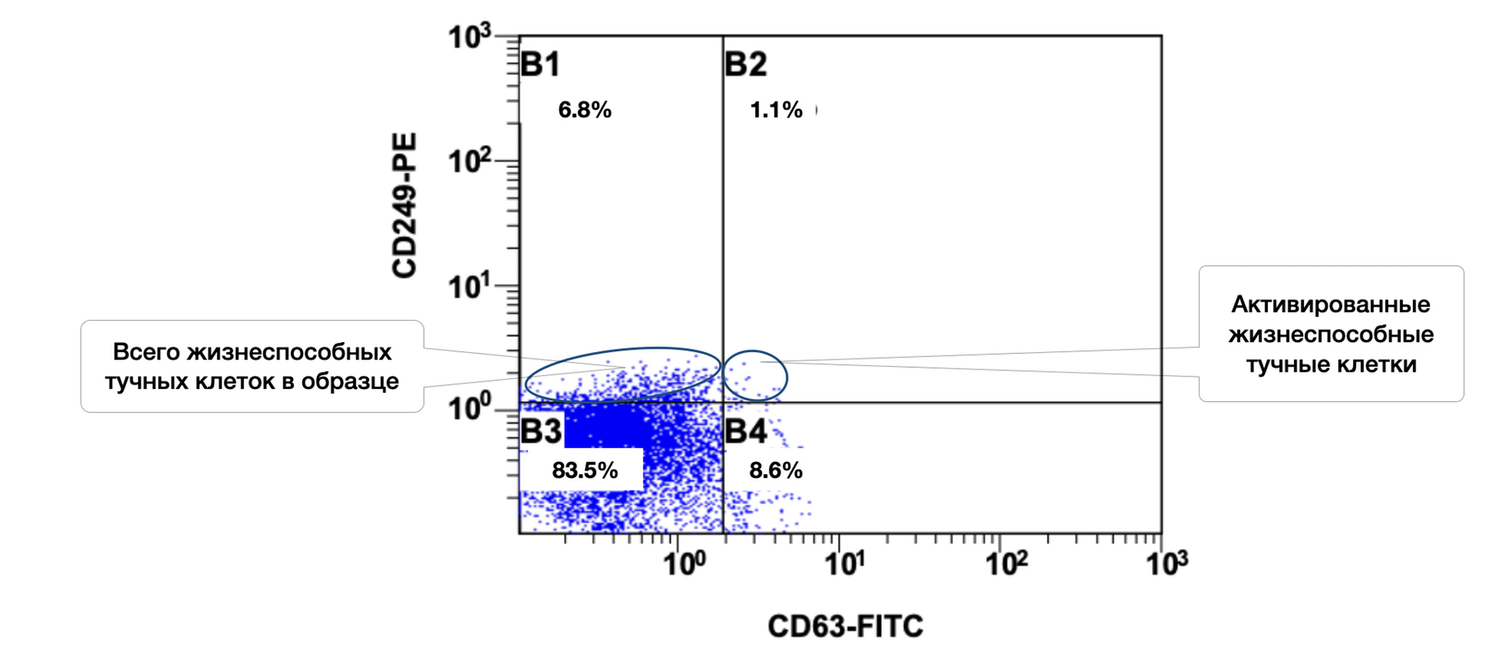
Рисунок 41. Соотношение относительного количества жизнеспособных тучных клеток (фенотип CD249+) и их активированных форм (фенотип CD249+ CD63+) в суспензии клеток биоптата кожи человека
Цитоиммунограмма, иллюстрирующая соотношение жизнеспособных и активированных тучных клеток в клеточной суспензии биоптата кожи (рис. 41), определяет среди жизнеспособных тучных клеток (CD249⁺) долю тех, которые проявляют признаки активации (CD63⁺). Этот анализ позволяет оценить уровень местной воспалительной активности и дегрануляции.
Ось X — CD63-FITC. Маркер активации тучных клеток — CD63 экспрессируется на поверхности при дегрануляции.
Ось Y — CD249-PE (c-Kit, SCFR). Специфический маркер тучных клеток, определяет их принадлежность к данной популяции.
Выделенные популяции:
|
Область |
Характеристика |
Процент |
Цвет |
|---|---|---|---|
|
B3 |
Жизнеспособные, неактивированные тучные клетки (CD249⁺ CD63⁻) |
83.5% |
Синий |
|
B4 |
Активированные тучные клетки (CD249⁺ CD63⁺) |
8.6% |
Синий |
|
B1 + B2 |
Высокоэкспрессирующие CD249 (возможно двойные положительные или шум) |
7.9% |
- |
Интерпретация:
Общая доля жизнеспособных тучных клеток в выборке составляет: 83.5% + 8.6% = 92.1%, что подтверждает сохранность популяции тучных клеток в кожном биоптате.
Из них 8.6% — активированы, что может указывать на: локальную воспалительную реакцию (например, в зоне хронического дерматита, псориаза, аллергии) и фоновую или индуцированную дегрануляцию тучных клеток.
Маркер CD63 используется как индикатор де-грануляции — выброса гистамина и медиаторов воспаления. Повышение этой популяции может быть значимо при оценке эффективности терапии (например, стабилизаторов мембран тучных клеток) или при диагностике гиперчувствительности.
CD249⁺ CD63⁺ тучные клетки — индикатор их активации и участия в воспалительном процессе; снижение этой популяции может свидетельствовать об эффективности антигистаминной или противовоспалительной терапии; повышение — обострение или активная стадия дерматологического заболевания (например, атопического дерматита, контактной экземы, розацеа и др.).
Таким образом, в данной пробе кожи жизнеспособные тучные клетки составляют основную часть популяции, при этом около 1/10 из них находятся в активированном состоянии, что делает данную диаграмму крайне информативной при оценке иммунного статуса кожи, мониторинге терапии и фенотипической дерматологической диагностике.
Одновременно, здесь же видно, что 7 % моноцитов, из них в состоянии активности 2,6 % (рис. 42).
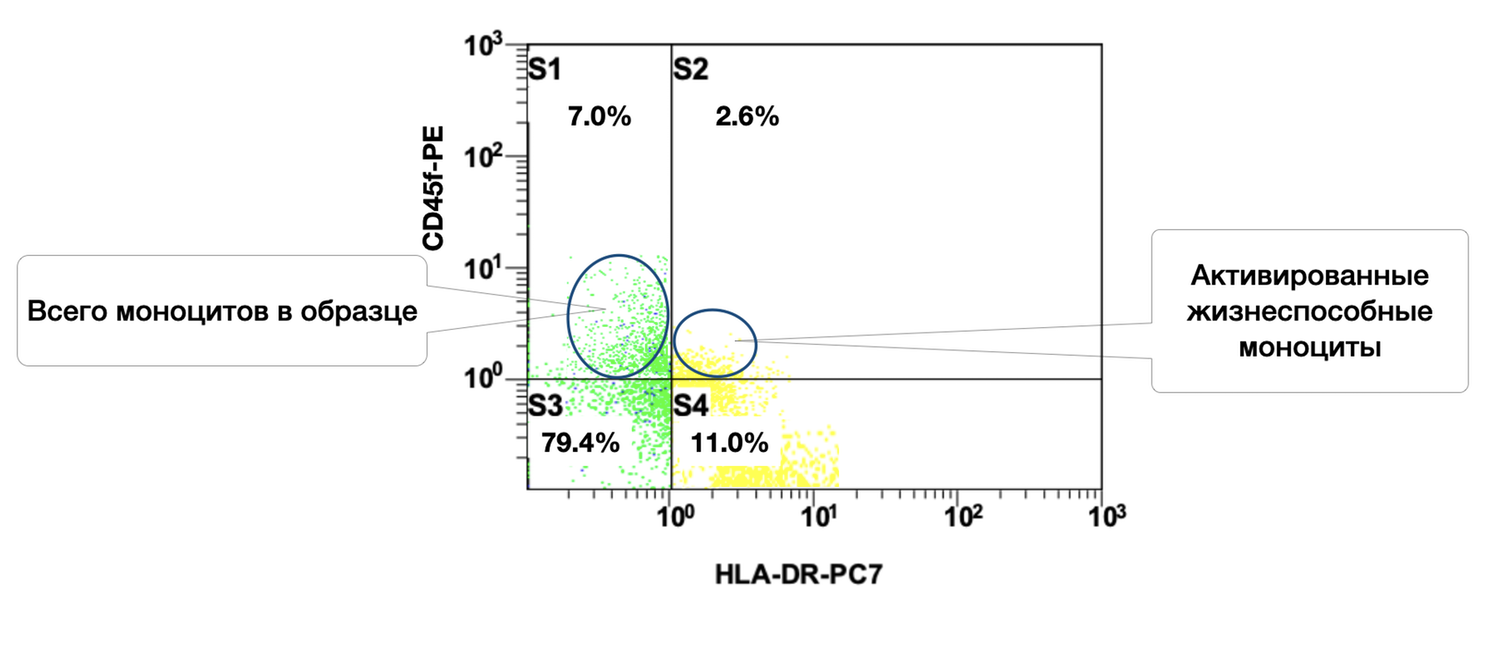
Рисунок 42. Соотношение относительного количества жизнеспособных моноцитов (фенотип CD45+ CD14+) и их активированных форм (фенотип CD45+ CD14+ HLA-DR+) в суспензии клеток биоптата кожи человека
Цитоиммунограмма (рис. 42) отражает соотношение жизнеспособных и активированных моноцитов в клеточной суспензии биоптата кожи человека и позволяет определить, какое количество жизнеспособных моноцитов (CD45⁺ CD14⁺) в кожной биопсии находится в состоянии активации, то есть экспрессирует HLA-DR — молекулу главного комплекса гистосовместимости II класса, участвующую в антиген-презентации.
Ось X — HLA-DR-PC7. Маркер активации моноцитов и антигенпрезентирующих клеток.
Ось Y — CD45-PE. Общий лейкоцитарный маркер, используемый для идентификации иммунных клеток, включая моноциты.
Выделенные популяции:
|
Область |
Характеристика |
Процент |
Цвет маркеров |
|---|---|---|---|
|
S3 |
Жизнеспособные, неактивированные моноциты (CD45⁺ CD14⁺ HLA-DR⁻) |
79.4% |
Зелёный |
|
S4 |
Активированные моноциты (CD45⁺ CD14⁺ HLA-DR⁺) |
11.0% |
Жёлтый |
|
S1 + S2 |
Вероятно, другие иммунные клетки или шум |
9.6% |
- |
Интерпретация:
Общая доля жизнеспособных моноцитов в выборке составляет: 79.4% + 11.0% = 90.4% — очень хороший показатель клеточной сохранности.
Из них 11.0% экспрессируют HLA-DR, что может указывать на: участие в локальном воспалительном процессе; функциональную активность антиген-презентирующих клеток; наличие иммунной активации в дерме (например, при дерматозах аутоиммунной природы, микробном воспалении, травматизации и др.).
CD45⁺ CD14⁺ HLA-DR⁺ моноциты — важный маркер врождённого иммунного ответа. Повышенное их содержание в кожной биопсии может быть признаком: усиленной антиген-презентации, иммунной инфильтрации при хронических воспалениях. Снижение возможно при иммуносупрессии или плохой репрезентативности ткани.
В данном образце ткани кожи большинство моноцитов жизнеспособны, что позволяет проводить функциональные и фенотипические исследования и около 11% активированы, что может указывать на вовлечение врождённого иммунитета в патогенез локального процесса и имеет ценность для фенотипической дерматологии, особенно при оценке воспалительных и аутоиммунных состояний.
Жизнеспособных внутриэпидермальных макрофагов в образце кожи 47,9 %, из них в состоянии активности 4,9 % (рис. 43).
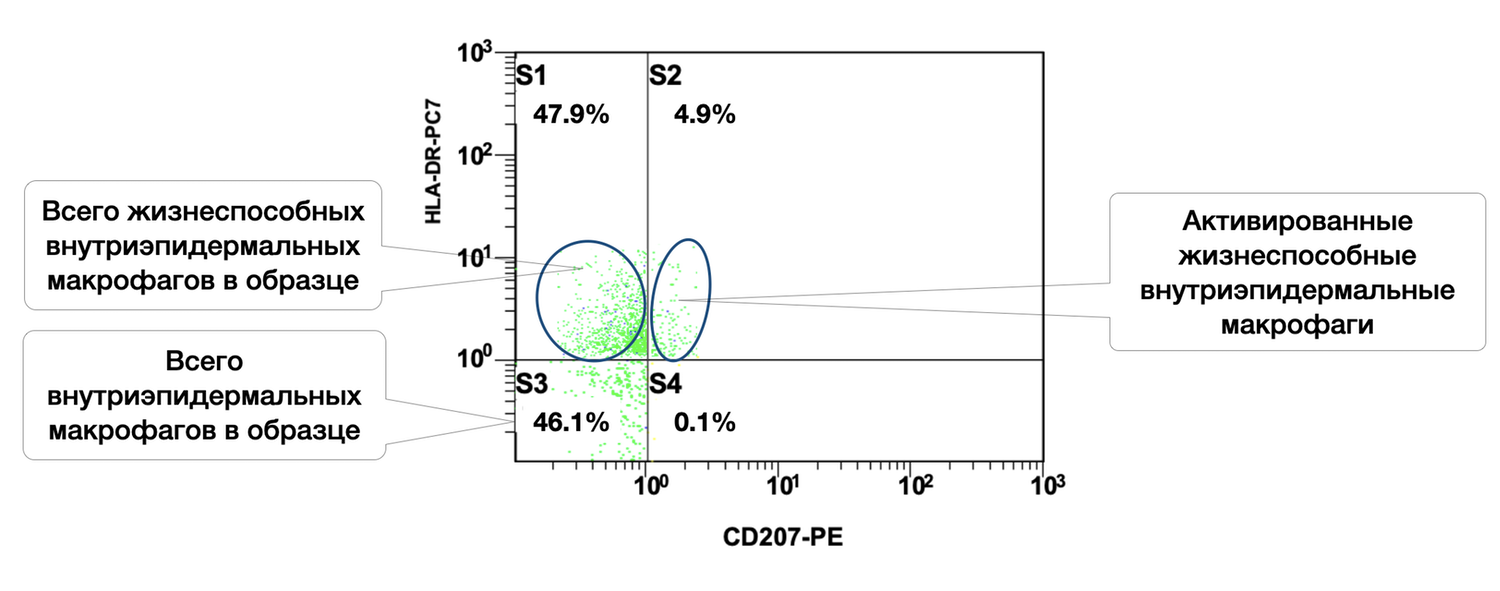
Рисунок 43. Соотношение относительного количества жизнеспособных внутриэпидермальных макрофагов (фенотип CD207+) и их активированных форм (фенотип CD207+ HLA-DR+) в суспензии клеток биоптата кожи человека
Цитоиммунограмма (рис. 43) демонстрирует соотношение жизнеспособных и активированных внутриэпидермальных макрофагов в клеточной суспензии биоптата кожи, оценивая относительное количество жизнеспособных внутриэпидермальных макрофагов (идентифицированных по экспрессии CD207 / langerin) и долю среди них, находящуюся в состоянии активации (HLA-DR⁺).
Ось X — CD207-PE. Маркер внутриэпидермальных макрофагов (лангергансовских клеток), специфичных для эпидермиса.
Ось Y — HLA-DR-PC7. Маркер функциональной активации, характерный для антигенпрезентирующих клеток.
Выделенные популяции:
|
Область |
Характеристика |
Процент |
Цвет популяции |
|---|---|---|---|
|
S3 |
Жизнеспособные, неактивированные внутриэпидермальные макрофаги (CD207⁺ HLA-DR⁻) |
46.1% |
Зелёный |
|
S4 |
Активированные внутриэпидермальные макрофаги (CD207⁺ HLA-DR⁺) |
0.1% |
Зелёный |
|
S1 |
Внутриэпидермальные макрофаги, HLA-DR⁺, но CD207⁻ — вероятно, другие АПК |
47.9% |
Не указано |
|
S2 |
HLA-DR⁺, CD207⁺ — вне основной популяции (шум, двойные клетки, неспецифичность?) |
4.9% |
Не указано |
Интерпретация:
Общее количество CD207⁺ клеток (внутриэпидермальных макрофагов) составляет: S3 + S4 = 46.1% + 0.1% = 46.2%. Из них только 0.1% экспрессируют HLA-DR, что может означать следующее:
состояние покоя или толерантности;
низкий уровень иммунной стимуляции в момент забора биопсии;
физиологическое отсутствие активации в нормальной коже.
Высокая доля S1 (47.9%) может включать как другие дермальные антиген-презентирующие клетки, так и фоновые клетки, требующие дополнительной оценки.
CD207⁺ HLA-DR⁺ клетки — функционально активные клетки Лангерганса, способные к миграции и презентации антигенов T-клеткам. Очень низкая их доля (0.1%) может быть характерна для: нормальной неинфицированной кожи, физиологического состояния гомеостаза или, наоборот, свидетельствовать об истощении / деактивации при хроническом воспалении.
Таким образом, в кожной биопсии этого пациента наблюдается высокая представленность CD207⁺ внутриэпидермальных макрофагов, но практически полное отсутствие их активации (по маркеру HLA-DR). Это может быть нормой в условиях отсутствия раздражителя, но также должно рассматриваться в контексте других клеток иммунного профиля кожи — моноцитов, тучных клеток, фибробластов и кератиноцитов.
Также в данном образце кожи эндотелиальные клетки представлены в активированном состоянии 5,4 % одним и 5,9 % двумя признаками, но всего жизнеспособных эндотелиоцитов 60,3 % (рис. 44).
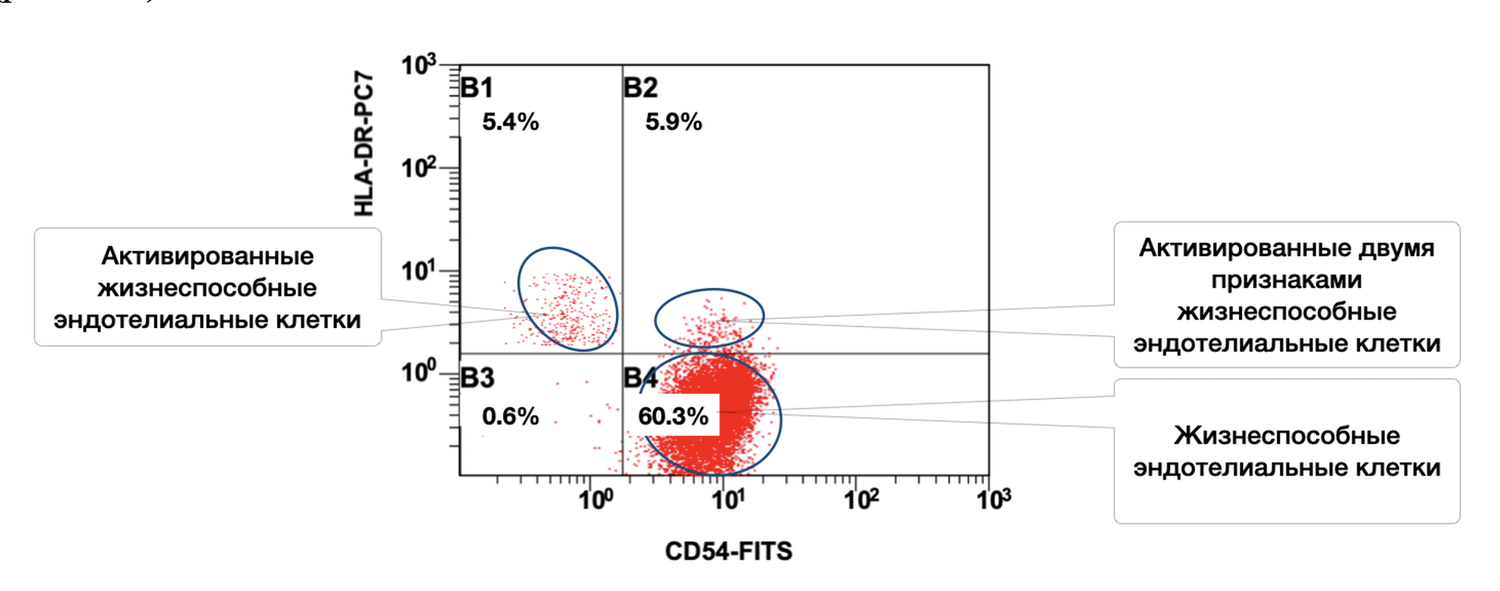
Рисунок 44. Соотношение относительного количества жизнеспособных эндотелиальных клеток (фенотип CD146+) и их активированных форм (фенотипы CD146+ HLA-DR+; CD146+ CD54+; CD146+ CD54+ HLA-DR+) в суспензии клеток биоптата кожи человека
Цитоиммунограмма (рис. 44) отражает соотношение жизнеспособных и активированных эндотелиальных клеток (фенотип CD146⁺) в суспензии клеток кожного биоптата. Это позволяет определить относительное количество жизнеспособных эндотелиальных клеток (по маркеру CD146) и выделить среди них активированные формы, идентифицируемые по одному или двум дополнительным активационным признакам:
HLA-DR⁺ — признак антигенпрезентации;
CD54⁺ (ICAM-1) — маркер воспалительной активации и адгезии;
CD54⁺ HLA-DR⁺ — комбинированная активация.
Параметры этой цитоиммунограммы:
Ось X — CD54-FITC. Поверхностная молекула адгезии (ICAM-1), повышается при воспалении.
Ось Y — HLA-DR-PC7. Молекула MHC II класса — маркер презентации антигена, активации и иммунной активности.
Выделенные популяции:
|
Область |
Характеристика |
Процент |
Цвет/метка |
|---|---|---|---|
|
B4 |
Жизнеспособные, неактивированные эндотелиальные клетки (CD146⁺ CD54⁻ HLA-DR⁻) |
60.3% |
Красные клетки |
|
B2 |
Активированные по CD54 (CD146⁺ CD54⁺ HLA-DR⁻) |
5.9% |
Красные клетки |
|
B1 |
Активированные по HLA-DR (CD146⁺ HLA-DR⁺ CD54⁻) |
5.4% |
Красные клетки |
|
B3 |
Двойная активация: CD54⁺ HLA-DR⁺ (CD146⁺ CD54⁺ HLA-DR⁺) |
0.6% |
Красные клетки |
Интерпретация:
Суммарное количество жизнеспособных эндотелиальных клеток (CD146⁺) в образце: B4 + B2 + B1 + B3 = 60.3% + 5.9% + 5.4% + 0.6% = 72.2%. Из них в состоянии активации находятся только по HLA-DR⁺: 5.4%; только по CD54⁺: 5.9%; двойная активация (CD54⁺ HLA-DR⁺): 0.6%; всего активированных форм: 11.9% (суммарно без учёта возможного перекрытия, т.к. диаграмма логически делит популяции).
Физиологическое значение:
CD146⁺ клетки — это эндотелиальные клетки микрососудов дермы, участвующие в регуляции сосудистого тонуса, проницаемости, лейкоцитарной миграции.
Активированные формы (CD54⁺ и/или HLA-DR⁺) отражают локальное воспаление, участие в иммунном ответе или ответ на повреждение.
Доля активированных эндотелиальных клеток (11.9%) в норме может варьировать, но является признаком умеренного физиологического иммунного тонуса кожи.
Таким образом, ванной кожной биопсии доминируют неактивированные жизнеспособные эндотелиальные клетки (60.3%), доля иммунологически активированных форм составляет около 12%, что указывает на возможное участие сосудистого эндотелия в низкоуровневом иммунном контроле или поствоспалительном восстановлении.
Приведенные в качестве демонстрации возможностей проточной цитометрии для прецизионной диагностики состояния кожи результаты обследования условно здорового добровольца могут быть интерпретированы следующим образом:
Эти выводы опираются на фактический результат анализа клеточного состава, жизнеспособности и степени активации клеточных популяций в суспензии из одного и того же биоптата кожи человека по данным проточной цитометрии. Такой анализ клеточной суспензии позволил оценить как общую жизнеспособность, так и степень активации ключевых популяций клеток, участвующих в поддержании кожного гомеостаза и воспалительных реакциях. Для удобства сводного восприятия информации и её роли в диагностическом значении, ниже приводится описание каждой популяции с указанием доли жизнеспособных и активированных клеток в образце.
Жизнеспособные клетки: 54,2%
Активированные клетки среди жизнеспособных (CD49f+ HLA-DR+): 41,4%
Комментарий: Значительная часть кератиноцитов активирована, что может свидетельствовать об иммунологической или репаративной активности эпидермиса.
Жизнеспособные клетки: 86,0%
Активированные клетки среди жизнеспособных (CD44+ CD80+): 6,2%
Комментарий: Высокая жизнеспособность, но умеренно низкий уровень активации — типично для покоящихся дермальных фибробластов.
Жизнеспособные клетки: 83,5%
Активированные клетки среди жизнеспособных (CD249+ CD63+): 8,6%
Комментарий: Активация тучных клеток указывает на возможное участие в аллергической или воспалительной реакции кожи.
Жизнеспособные клетки: 79,4%
Активированные клетки среди жизнеспособных (CD45+ CD14+ HLA-DR+): 11,0%
Комментарий: Присутствие активированных моноцитов подтверждает локальную иммунную активность и возможно участие в антиген-презентации.
Жизнеспособные клетки: 47,9%
Активированные клетки среди жизнеспособных (CD207+ HLA-DR+): 4,9%
Комментарий: Самая низкая жизнеспособность среди всех популяций, что может быть связано с хрупкостью этих клеток в условиях выделения.
Жизнеспособные клетки (CD146+): 60,3%
Активированные клетки:
CD146+ CD54+: 5,9%
CD146+ HLA-DR+: 5,4%
CD146+ CD54+ HLA-DR+ (двойная активация): значимая, входит в состав обеих фракций.
Комментарий: Присутствие активации по ICAM-1 (CD54) и HLA-DR отражает вовлечённость эндотелия в регуляцию локального воспаления и миграции иммунных клеток.
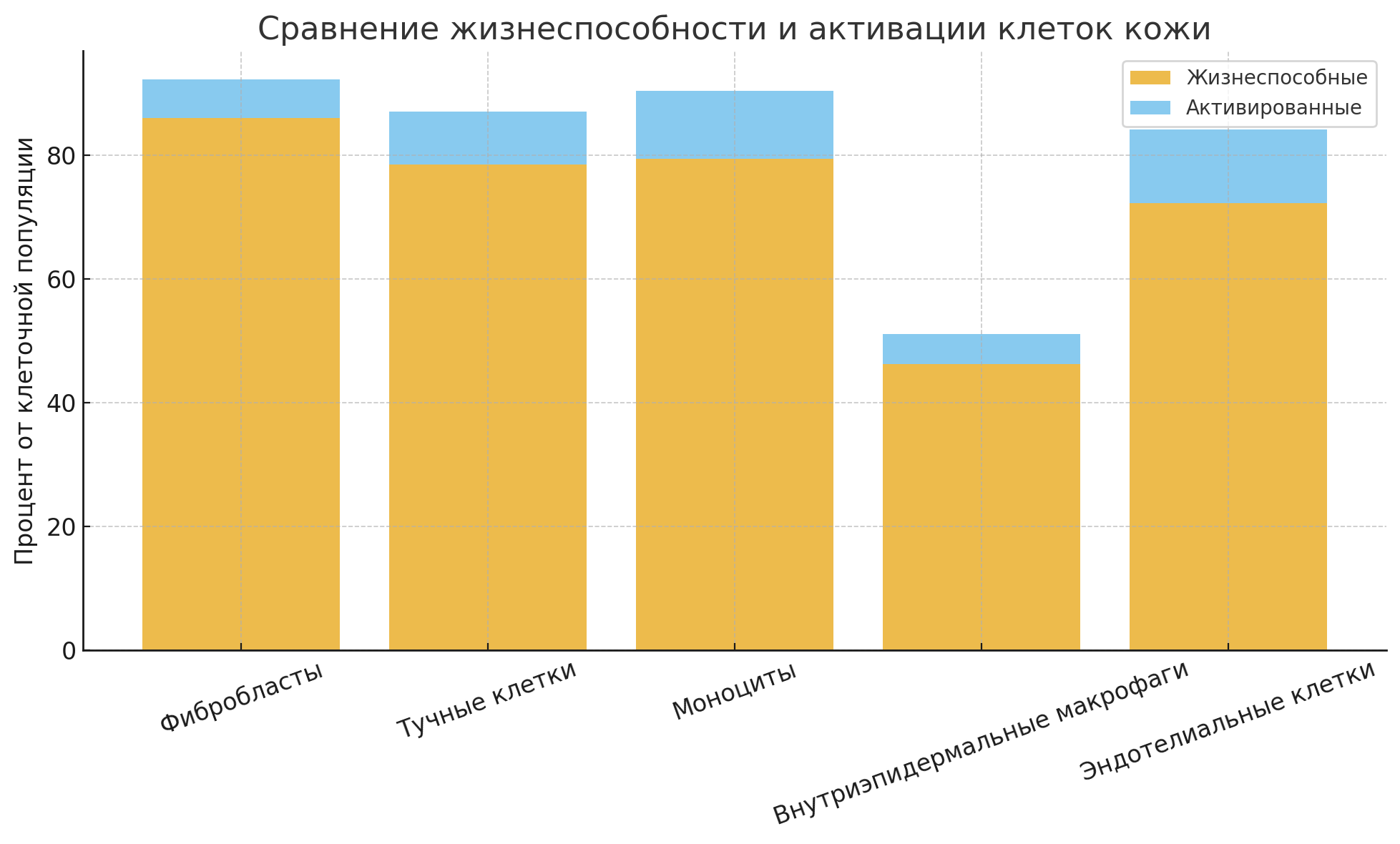
Свод по клеточным популяциям:
| Клеточная популяция | Жизнеспособность (%) | Активация (%) |
|---|---|---|
| Фибробласты | 86,0 | 6,2 |
| Тучные клетки | 83,5 | 8,6 |
| Моноциты | 79,4 | 11,0 |
| Кератиноциты | 54,2 | 41,4 |
| Эндотелиальные клетки | 60,3 | ~11 (суммарно) |
| Внутриэпидермальные макрофаги | 47,9 | 4,9 |
Таким образом,
Наиболее жизнеспособными оказались фибробласты и тучные клетки, что соответствует их устойчивости и стабильному присутствию в дерме.
Наибольшую степень активации показали кератиноциты (возможно, при повреждении или воспалении), а также моноциты и эндотелиальные клетки.
Минимальная жизнеспособность зафиксирована у внутриэпидермальных макрофагов, что может быть связано с их высокой чувствительностью к изоляции.
Дифференцированная оценка активации (по нескольким маркерам) позволяет более точно судить о функциональном состоянии клеток.
Данный пример позволяет использовать способ оценки фенотипа у более широкой выборки добровольцев с целью определения половозрастных особенностей количественно-функционального состояния клеток кожи.
У 80 здоровых добровольцев, разделенных на группы по полу и возрасту, по 16 человек в каждой, была выполнена биопсия кожи, из биоптата которой выделены субпопуляции клеток для фенотипирования и построения цитоиммунограмм кожи.
Статистическая обработка результатов проводилась дескриптивными методами в виде средней арифметической и ее стандартной ошибки (M±m), с применением t-критерия Стьюдента для определения статистической значимости различий средних величин с нормальным распределением исходных данных57.
В результате из общей гетерогенной популяции клеток кожи были получены отдельные жизнеспособные субпопуляции клеток из нативного и криоконсервированного образца, определен фенотип клеток, их функциональная активность и жизнеспособность (табл. 1).
Таблица 1. Сравнительная оценка количественного и функционального состояния жизнеспособных клеток в нативных и криоконсервированных биоптатах кожи условно здоровых лиц, n=80
|
Субпопуляции клеток кожи и жизнеспособность |
Фенотип |
Нативный образец, % |
Криоконсервированный образец, % |
|
Кератиноциты, из них активированные |
CD49f+ CD49f+ HLA-DR+ |
70,25±3,75 3,25±0,75 |
68,2±2,01 1,3±0,04 |
|
Фибробласты, из них активированные |
CD45– CD14– CD44+ CD45– CD14– CD44+ CD80+ |
76,5±3,5 4,93±2,47 |
66,8±4,0 3,5±0,2 |
|
Клетки Лангерганса, из них активированные |
CD207+ CD207+ CD80– HLA-DR+ CD207+ CD80+ HLA-DR– CD207+ CD80+ HLA-DR+ |
48±1,0 3,8±0,9 5,1±1,1 3,7±0,7 |
46,4±1,2 3,6±0,8 1,3±0,05 3,5±0,9 |
|
CD146+ CD146+ CD 54– HLA-DR+ CD146+ CD 54+ HLA-DR– CD146+ CD 54+ HLA-DR+ CD146+ CD 34+ |
1,32±0,98 0 22,88±2,52 0,33±0,17 6,93±1,07 |
0,6±0,03 0 50,0±4,6 0,40±0,12 36,0±5,2 |
|
|
Тучные клетки, из них активированные |
CD249+ CD249+ CD63+ |
3,43±1,77 1,1±0,2 |
2,5±0,99 1,6±0,3 |
|
Моноциты, из них активированные |
CD45+ CD14+ CD45+ CD14+ HLA-DR+ |
7,75±1,25 0,23±0,16 |
5,6±1,01 0,28±0,14 |
|
Эпидермальные лимфоциты: Т-общие Т-хелперы Т-цитотоксические В-лимфоциты NK-клетки |
CD45+ CD3+ CD45+ CD3+ CD4+ CD8– CD45+ CD3+ CD4– CD8+ CD45+ CD3+ CD19+ CD45+ CD3– CD16+ CD56+ |
14,0±1,0 10,5±1,5 2,5±0,5 6,0±1,0 10,5±1,5 |
11,2±1,99 9,9±0,75 1,3±0,22 7,0±1,05 9,5±1,14 |
|
Жизнеспособность, % |
99,8±0,9 |
87,0±0,5 |
При сравнении данных процентного соотношения клеток кожи двух образцов получены следующие результаты.
Общая жизнеспособность клеток после криоконсервации сохранялась на высоком уровне – 87,0 ± 0,5 %, что составляет около 87 % от нативного показателя (99,8 ± 0,9 %). Это свидетельствует о сохранности клеточных структур и мембранной целостности при примененной методике криопротекции.
Кератиноциты (CD49f+ HLA-DR+) и фибробласты (CD45– CD14– CD44+) демонстрируют незначительное снижение численности в криоконсервированных образцах (на ~10 %), при этом доля активированных форм остается в пределах статистической погрешности, что указывает на сохранение базового метаболического и репаративного потенциала тканей.
Клетки Лангерганса (CD207+ CD80+ HLA-DR+) и их активированные субпопуляции характеризуются умеренным снижением активности после заморозки (на ~3–5 %), однако относительные соотношения DR+/DR– остаются стабильными. Это говорит о сохранении иммунопрезентирующей функции эпидермиса.
В группе эндотелиоцитов (CD146+) и их подтипов наблюдаются более выраженные изменения – доля DR+ клеток снижается почти вдвое (с 6,9 % до 3,6 %), что может отражать чувствительность сосудистого эндотелия к криогенной нагрузке.
Тучные клетки (CD249+ CD63+) и моноциты (CD45+ CD14+) демонстрируют умеренное уменьшение доли активированных клеток, при этом общие количественные значения остаются стабильными, что указывает на относительную устойчивость этих субпопуляций.
Среди эпидермальных лимфоцитов отмечено снижение общей доли Т-клеток (CD45+ CD3+) и T-хелперов (CD4+) при сохранении или легком увеличении цитотоксических CD8+ клеток. Это отражает сдвиг фенотипического баланса в сторону регуляторно-супрессорных звеньев после криоконсервации.
Таким образом:
криоконсервация по примененному протоколу обеспечивает сохранность жизнеспособности клеток кожи на уровне более 85 % с минимальными изменениями субпопуляционного состава;
наиболее устойчивыми к замораживанию оказались фибробласты, кератиноциты и тучные клетки, более чувствительными – эндотелиальные и антигенпрезентирующие клетки;
разработанная методика обеспечивает возможность последующего фенотипического анализа и построения достоверной цитоиммунограммы кожи как в нативных, так и в криоконсервированных образцах.
Этот результат позволяет рекомендовать криоконсервацию в качестве способа сохранения образца для дальнейших наблюдений в динамике. Деление обследованных по полу и возрасту было необходимым, чтобы показать различие измеряемых параметров в разных половозрастных группах.
При этом среднестатистическая характеристика (табл. 2, ч.1 и 2) сделана для демонстрации возможностей скрининговых подходов в оценке фенотипа субпопуляций клеток кожи.
Таблица 2, часть 1. Среднестатистическая характеристика фенотипов основных субпопуляций клеток кожи в биоптате условно здоровых лиц с распределением по полу и возрасту, n=80 (мужчины)
|
Субпопуляции клеток кожи и жизнеспособность |
Фенотип |
Мужчины, n=40 |
||||
|
15–25 лет |
26–35 лет |
36–45 лет |
46–55 лет |
56–65 лет |
||
|
Кератиноциты, из них активированные |
CD49f+ CD49f+ HLA-DR+ |
74,98±2,11* 4,98±0,32* |
70,25±3,75 3,25±0,75 |
69,5±3,5 3,23±0,37 |
61,0±5,0 2,78±0,62 |
55,75±2,25* 2,25±0,65* |
|
Фибробласты, из них активированные |
CD45– CD14– CD44+ CD45– CD14– CD44+ CD80+ |
82,75±1,25* 7,15±1,15* |
76,5±3,5 4,93±2,47 |
72±5,0 4,13±1,27 |
66,5±3,5 2,4±0,47 |
61,25±1,75* 3,18±0,82* |
|
Клетки Лангерганса, из них активированные |
CD207+ CD207+ CD80– HLA-DR+ CD207+ CD80+ HLA-DR– CD207+ CD80+ HLA-DR+ |
52,0±4,0* 0,18±0,02* 5,48±0,62 0,25±0,05 |
48±1,0 3,8±0,9 5,1±1,1 0 |
45,5±4,5 0,27±0,13 5,25±0,95 0,73±0,27 |
43,0±2,0 1,3±0,4 5,7±1,3 0,3±0,1 |
36,0±3,0* 1,15±0,35* 7,5±1,5 0 |
|
Эндотелиальные клетки, из них активированные |
CD146+ CD146+ CD54– HLA-DR+ CD146+ CD54+ HLA-DR– CD146+ CD54+ HLA-DR+ CD146+ CD34+ |
0,9±0,1 0 27,38±1,62* 4,15±0,85* 11,52±2,62* |
1,32±0,98 0 22,88±2,52 0,33±0,17 6,93±1,07 |
1,03±0,17 0,18±0,02 22,23±0,17 1,35±0,25 3,35±0,27 |
1,28±0,12 0 19,73±0,17* 1,43±0,27 1,42±0,08 |
1,1±0,2 0,08±0,02 18,85±1,55* 1,32±0,42* 0,43±0,07* |
|
Тучные клетки, из них активированные |
CD249+ CD249+ CD63+ |
6,0±0,2* 3,63±1,27* |
3,43±1,77 1,1±0,2 |
4,23±0,77 2,4±0,3 |
3,78±0,42 1,15±0,05 |
4,06±0,43* 0,6±0,1* |
|
Моноциты, из них активированные |
CD45+ CD14+ CD45+ CD14+ HLA-DR+ |
6,8±0,4* 2,45±0,15* |
7,75±1,25 0,23±0,16 |
6,9±0,3 2,15±0,45 |
5,83±1,17 1,28±0,4 |
4,58±0,42* 0,3±0,02* |
|
Эпидермальные лимфоциты: Т-общие Т-хелперы Т-цитотоксические В-лимфоциты NK-клетки |
CD45+ CD3+ CD45+ CD3+ CD4+ CD8– CD45+ CD3+ CD4– CD8+ CD45+ CD3+ CD19+ CD45+ CD3– CD16+ CD56+ |
15,75±1,25 11,5±2,5 3,75±1,75 7,5±0,5 9,75±2,25 |
14,0±1,0 11,0±1,0 2,5±0,5 6,0±1,0 10,5±1,5 |
13,25±0,75 7,23±3,77 4,0±1,0 6,25±1,75 10,75±1,25 |
13,75±1,25 10,5±0,5 3,25±1,75 5,25±1,75 7,5±0,5 |
12,5±1,5 9,75±0,25 2,75±1,25 4,5±1,5 6,5±1,5 |
|
Жизнеспособность, % |
84,75±4,25 |
86,0±4,0 |
88,5±1,5 |
84,75±4,25 |
83,25±5,75 |
|
В первой части таблицы 2 представлены результаты проточной цитометрии клеточных суспензий кожи, отражающие количественное распределение и фенотипическую активность основных субпопуляций клеток в различных возрастных группах мужчин (от 15 до 65 лет). Показатели выражены в процентах от общего числа живых клеток (среднее ± стандартное отклонение).
Основные наблюдения даны ниже.
Кератиноциты (CD49f+ HLA-DR+). Отмечено закономерное снижение доли жизнеспособных и активированных кератиноцитов с возрастом: от 74,98 ± 2,11 % в группе 15–25 лет до 55,75 ± 2,25 % у мужчин 56–65 лет (p<0,05). Это отражает возрастное истощение эпидермального регенераторного потенциала.
Фибробласты (CD45– CD14– CD44+). Аналогичная тенденция – постепенное уменьшение числа фибробластов и активированных форм (CD80+) после 35 лет (с 82,75 ± 1,25 % до 61,25 ± 1,75 %), что указывает на снижение дермального матриксного метаболизма и репаративной активности.
Клетки Лангерганса (CD207+). Количество и степень активации клеток Лангерганса снижаются после 35 лет, наиболее выражено – после 55 лет (с 52,0 ± 4,0 % до 36,0 ± 3,0 %, p<0,05). Это может свидетельствовать о снижении антигенпрезентирующей функции эпидермиса и возрастной иммунной перестройке.
Эндотелиальные клетки (CD146+). Возрастное снижение наблюдается преимущественно в DR+ подтипах (с 11,5 ± 2,6 % до 0,43 ± 0,07 %), что отражает угасание ангиогенной активности кожи и замедление процессов неоангиогенеза.
Тучные клетки (CD249+ CD63+). Показатели остаются относительно стабильными во всех возрастных группах (3,4–4,0 %), однако активированные формы (CD63+) проявляют небольшое увеличение после 45 лет, что может отражать нарастание воспаления.
Моноциты (CD45+ CD14+). Доля активированных моноцитов (HLA-DR+) снижается к старшим возрастным группам (с 2,45 ± 0,15 % до 0,3 ± 0,02 %), что указывает на сдвиг иммунного ответа от активного воспаления к более регуляторному профилю.
Эпидермальные лимфоциты (CD45+ CD3+). В целом наблюдается тенденция к уменьшению общего пула Т-лимфоцитов и Т-хелперов (CD4+) при сохранении уровня цитотоксических клеток (CD8+). Это свидетельствует о снижении адаптивного звена иммунитета с возрастом при относительном сохранении цитотоксического потенциала.
Жизнеспособность клеток кожи. Показатель жизнеспособности клеток снижается с 88,5 ± 1,5 % у мужчин 15–25 лет до 83,25 ± 5,75 % в группе 56–65 лет, что подтверждает общую возрастную тенденцию к редукции репаративных и иммунных резервов кожи.
Условно здоровая кожа мужчин демонстрирует четкую возрастную фенотипическую динамику, которая характеризуется следующим:
Эти данные подтверждают, что клеточный и фенотипический возраст кожи может служить более точным критерием ее состояния, чем хронологический возраст, и подчеркивают необходимость применения фенотипической дерматологии для стратификации пациентов и прогнозирования ответов на терапию.
Таблица 2, часть 2. Среднестатистическая характеристика фенотипов основных субпопуляций клеток кожи в биоптате условно здоровых лиц с распределением по полу и возрасту, n=80 (женщины)
|
Субпопуляции клеток кожи и жизнеспособность |
Фенотип |
Женщины, n=40 |
||||
|
15–25 лет |
26–35 лет |
36–45 лет |
46–55 лет |
56–65 лет |
||
|
Кератиноциты, из них активированные |
CD49f+ CD49f+ HLA-DR+ |
73,25±1,75* 3,08±0,92 |
66,5±2,5 3,93±0,07 |
67,25±1,75 4,3±0,9 |
55,66±3,33* 1,97±0,23 |
43,33±3,67* 2,05±0,45 |
|
Фибробласты, из них активированные |
CD45– CD14– CD44+ CD45– CD14– CD44+ CD80+ |
78,5±0,5* 9,55±0,85* |
71,25±0,75 4,68±0,72 |
71,25±2,75 5,4±1,0 |
61,0±1,0* 2,0±0,1* |
55,0±2,0* 0,4±0,2* |
|
Клетки Лангерганса, из них активированные |
CD207+ CD207+ CD80– HLA-DR+ CD207+ CD80+ HLA-DR– CD207+ CD80+ HLA-DR+ |
46,5±1,5* 1,95±0,95 7,6±0,8 0,25±0,15 |
46,5±0,5 0,15±0,05 6,53±2,17 0,55±0,25 |
45,25±0,75 2,13±0,77 6,22±2,08 0,63±0,27 |
42,25±1,75 1,63±0,37 7,58±0,72 0,4±0,1 |
37,5±1,5* 0,9±0,01 8,65±1,35 0,45±0,05 |
|
Эндотелиальные клетки, из них активированные |
CD146+ CD146+ CD54– HLA-DR+ CD146+ CD54+ HLA-DR– CD146+ CD54+ HLA-DR+ CD146+ CD34+ |
1,05±0,65 0,23±0,07 26,95±1,75* 0 11,35±2,05* |
0,75±0,15 0 24,5±0,6 1,03±0,17 5,1±1,0* |
0,95±0,15 0 21,28±1,92 0,36±0,14 3,83±0,47* |
0,92±0,08 0,4±0,1 19,25±1,75* 1,1±0,1 1,67±0,63* |
0,95±0,2 0,75±0,25 16,75±0,25* 0 0,17±0,03* |
|
Тучные клетки, из них активированные |
CD249+ CD249+ CD63+ |
4,53±0,67 0,85±0,15 |
2,4±0,5* 0,68±0,3 |
3,2±1,0 1,1±0,5 |
3,72±0,28 1,38±0,12 |
4,48±0,92 0,96±0,53 |
|
Моноциты, из них активированные |
CD45+ CD14+ CD45+ CD14+ HLA-DR+ |
10,4±3,6* 0,67±0,19 |
7,03±0,03 1,13±0,37 |
8,5±1,5 1,95±0,45 |
4,5±0,3* 0,9±0,2 |
4,5±1,4* 0,26±0,06 |
|
Эпидермальные лимфоциты: Т-общие Т-хелперы Т-цитотоксические В-лимфоциты NK-клетки |
CD45+ CD3+ CD45+ CD3+ CD4+ CD8– CD45+ CD3+ CD4– CD8+ CD45+ CD3+ CD19+ CD45+ CD3– CD16+ CD56+ |
15,0±0,1 10,5±1,5* 4,5±0,5 7,0±1,0* 9,0±1,0 |
14,25±0,75 10,25±1,75 4,0±2,0 7,0±1,0 9,0±1,0 |
13,0±2,0 9,5±1,5 3,5±0,5 7,0±0,01 9,25±0,75 |
11,5±0,5 8,25±1,75 3,0±1,0 4,75±1,25 8,75±1,25 |
11,0±2,0 5,3±1,7* 3,75±1,25 4,5±0,5* 8,5±1,5 |
|
Жизнеспособность, % |
89,25±3,75 |
90,25±1,75 |
85,25±1,75 |
89,5±1,5 |
89,5±2,5 |
|
* Наблюдаемые различия статистически значимы – p<0,05.
Во второй части таблицы 2 приведены результаты фенотипического анализа клеточного состава кожи женщин в возрасте от 15 до 65 лет, полученные методом проточной цитометрии. Показаны средние значения долей клеток (в процентах) для основных субпопуляций и их активированных форм, характеризующих морфофункциональное состояние эпидермиса и дермы в различные возрастные периоды.
Основные наблюдения и тенденции показаны ниже.
Кератиноциты (CD49f+ HLA-DR+). У женщин наблюдается отчетливое снижение доли жизнеспособных и активированных кератиноцитов с возрастом – от 73,25 ± 1,75 % в группе 15–25 лет до 43,33 ± 3,67 % в группе 56–65 лет (p<0,05). Это отражает снижение скорости обновления эпидермиса и ослабление барьерно-регенераторных процессов после 45 лет.
Фибробласты (CD45– CD14– CD44+). Доля фибробластов уменьшается почти на 30 % в старших возрастных группах (с 78,5 ± 0,5 % до 55,0 ± 0,6 %), при этом активированные формы (CD80+) демонстрируют особенно заметное падение после 50 лет. Это указывает на возрастное снижение синтетической активности дермы и ослабление способности к ремоделированию внеклеточного матрикса.
Клетки Лангерганса (CD207+ CD80+ HLA-DR+). Их количество постепенно сокращается от 46,5 ± 1,5 % у молодых женщин до 37,5 ± 1,5 % после 55 лет, а активированные формы (CD80+ HLA-DR+) снижаются почти вдвое. Это отражает снижение антигенпрезентирующей функции и ослабление локального иммунного надзора в коже.
Эндотелиальные клетки (CD146+ CD54+ CD34+). Отмечается возраст-зависимое уменьшение активированных фенотипов (CD54+ CD34+), что говорит о снижении ангиогенной активности и микроциркуляторного потенциала кожи. Наиболее выраженные различия выявлены между группами 15–25 лет и 56–65 лет (p<0,05).
Тучные клетки (CD249+ CD63+). Их доля остается стабильной (около 3–4 %), однако количество активированных клеток (CD63+) после 45 лет слегка увеличивается. Это отражает тенденцию к повышенной сенсибилизации и участию мастоцитов в возраст-ассоциированных воспалительных реакциях.
Моноциты (CD45+ CD14+ HLA-DR+). С возрастом их общее количество снижается вдвое, а активированные формы (HLA-DR+) падают более чем в три раза, что указывает на угасание воспалительной активности и смещение иммунного профиля в регуляторную сторону.
Эпидермальные лимфоциты (CD45+ CD3+). У женщин также отмечается возраст-зависимое уменьшение пула Т-лимфоцитов, особенно Т-хелперов (CD4+), при относительной стабильности цитотоксического звена (CD8+) и В-лимфоцитов (CD19+). Это отражает общее ослабление адаптивного иммунного ответа кожи при сохранении базового цитотоксического резерва.
Жизнеспособность клеток кожи. Показатель жизнеспособности у женщин остается высоким и варьирует незначительно (85–90 %), что свидетельствует о более выраженной устойчивости кожных клеток женского пола к возрастным изменениям по сравнению с мужчинами.
Кожа женщин характеризуется более стабильным фенотипическим профилем, чем у мужчин, но также демонстрирует постепенное снижение регенераторной и иммунной активности с возрастом. Особенно выражены изменения в дермальном (фибробластном) и иммунопрезентирующем (Лангерганс-клеточном) звеньях, тогда как эпидермальные и тучные клетки сохраняют относительную функциональную устойчивость. Таким образом, полученные данные отражают гендерно-специфические особенности старения кожи и подтверждают значимость фенотипического подхода к ее оценке – как инструмента выявления клеточных признаков возрастной перестройки и прогноза эффективности омолаживающей и восстановительной терапии.
Помимо этого, сопоставление фенотипического состава клеток кожи у мужчин и женщин показывает, что, несмотря на общие возрастные закономерности деградации регенераторных и иммунных звеньев, характер и темп фенотипических изменений имеют выраженные половые различия.
У представителей обоих полов с возрастом наблюдаются общие тенденции:
Эти процессы отражают универсальный для кожи фенотип старения – переход от регенераторно-воспалительного к метаболически и иммунно-гипореактивному состоянию.
Вместе с тем у представителей наблюдаются гендерные различия в фенотипической динамике.
Мужчины:
Женщины:
Таким образом, мужская кожа стареет по типу раннего регенераторного истощения, тогда как женская – по типу позднего гормонально-модулированного структурного срыва (табл. 2, ч. 3).
Таблица 2, часть 3
Фенотипическая асимметрия полов
|
Параметр |
Мужчины |
Женщины |
|
Начало выраженных фенотипических изменений |
30–35 лет |
45–50 лет |
|
Темп снижения регенераторных клеток (CD34+ CD49f+) |
Постепенный, линейный |
Поздний, но быстрый |
|
Фибробластное звено |
Снижается раньше и сильнее |
Снижается позже, гормонозависимо |
|
Эндотелиальное звено (CD146+ CD54+) |
Сильнее редуцируется |
Относительно устойчиво |
|
Иммунное звено (CD207+ CD14+ CD4+) |
Истощение Th2/Th17 профиля |
Снижение антиген-презентации, но сохранение цитотоксического ответа |
|
Общая жизнеспособность клеток |
83–85 % в старших группах |
88–90 % в старших группах |
|
Тип старения |
Метаболически-гипореактивный |
Гормонально-иммунный |
В обоих случаях происходит фенотипический сдвиг от доминирования регенеративных и иммунно-активных субпопуляций к преобладанию малореактивных и дифференцированных клеток.
Эти различия подчеркивают необходимость персонализированной фенотипической стратификации пациентов при оценке кожных состояний, прогнозе старения и подборе терапевтических протоколов, что является одной из ключевых целей фенотипической дерматологии.
Проведенное обследование условно здоровых лиц позволило определить среднестатистические значения параметров фенотипического статуса кожи. Результаты, представленные в таблице 2, требуют уточнения, но начало положено.
Больная Л., 26 лет, поступила в дерматологическое отделение Тюменского ОКВД с жалобами на интенсивный кожный зуд (в том числе ночью), выраженную сухость и обильное шелушение кожи, отечность кожи, расчесы, трещины.
Больной себя считает более 15 лет, с тех пор, как в пубертатном возрасте появились первые высыпания на коже локтевых и подколенных сгибов. Диагноз атопический дерматит был установлен при первом визите. Обострения были до трех раз в год, всегда с госпитализациями. Получала лечение топическими ГКС, эмолентами, антигистаминными препаратами, топическими ингибиторами кальциневрина. Последние два года атопический дерматит непрерывно рецидивирует, осложняясь эритродермией и вторичным инфицированием расчесов. Получала лечение метилпреднизолоном внутривенно с курсами антибактериальной терапии и внутривенным лазерным облучением кожи. Всегда с удовлетворительным эффектом. Аллергологический и наследственный анамнез не отягощен. Обследование у аллерголога выявило аллергию к бытовым аллергенам.
При поступлении состояние тяжелой степени. Пациентка гипостенической конституции. Аускультативно дыхание везикулярное, хрипы не выслушиваются. ЧДД 16 в минуту. Тоны сердца ясные, ритмичные, ЧСС 76 в минуту, артериальное давление 110/70 мм рт. ст. Язык влажный, розовый. Живот мягкий, безболезненный при пальпации. Печень, селезенка не увеличены. Стул регулярный, без патологических примесей. Симптом поколачивания отрицательный с обеих сторон. Мочеиспускание безболезненное. Щитовидная железа визуально не увеличена, пальпация ее безболезненная. КТ легких без особенностей. УЗИ органов брюшной полости и щитовидной железы патологии не выявило. Общий анализ крови: гемоглобин – 107 г/л, СОЭ – 28 мм/ч; показатели анализа мочи в пределах нормы; показатели биохимического анализа крови в пределах нормы; гормоны щитовидной железы в пределах нормы. Анализ на гельминтозы отрицателен. Иммуноглобулины А, М, G в сыворотке крови в пределах нормы. Уровень СРБ крови – 9 мг/л. Общий IgE 5 500 МЕ/мл.
Патологический процесс носит распространенный характер, представлен яркой гиперемией сливного характера кожи туловища, конечностей, до состояния эритродермии. Сопровождается отечностью кожи, трещинами в локтевых сгибах и подколенных областях, обильным мелкопластинчатым шелушением с линейными расчесами скальпирующего характера по всей поверхности кожи, даже в тех местах, где пациентка не может дотянуться руками. В области розовой каймы губ трещины и шелушение (хейлит). Визуальных признаков пиодермии нет. Индекс SCORAD – 82. Паховые лимфоузлы увеличены с обеих сторон до размера лесного ореха, при пальпации безболезненны, подвижны, мягкоэластической консистенции, другие группы лимфоузлов интактны (рис. 45).
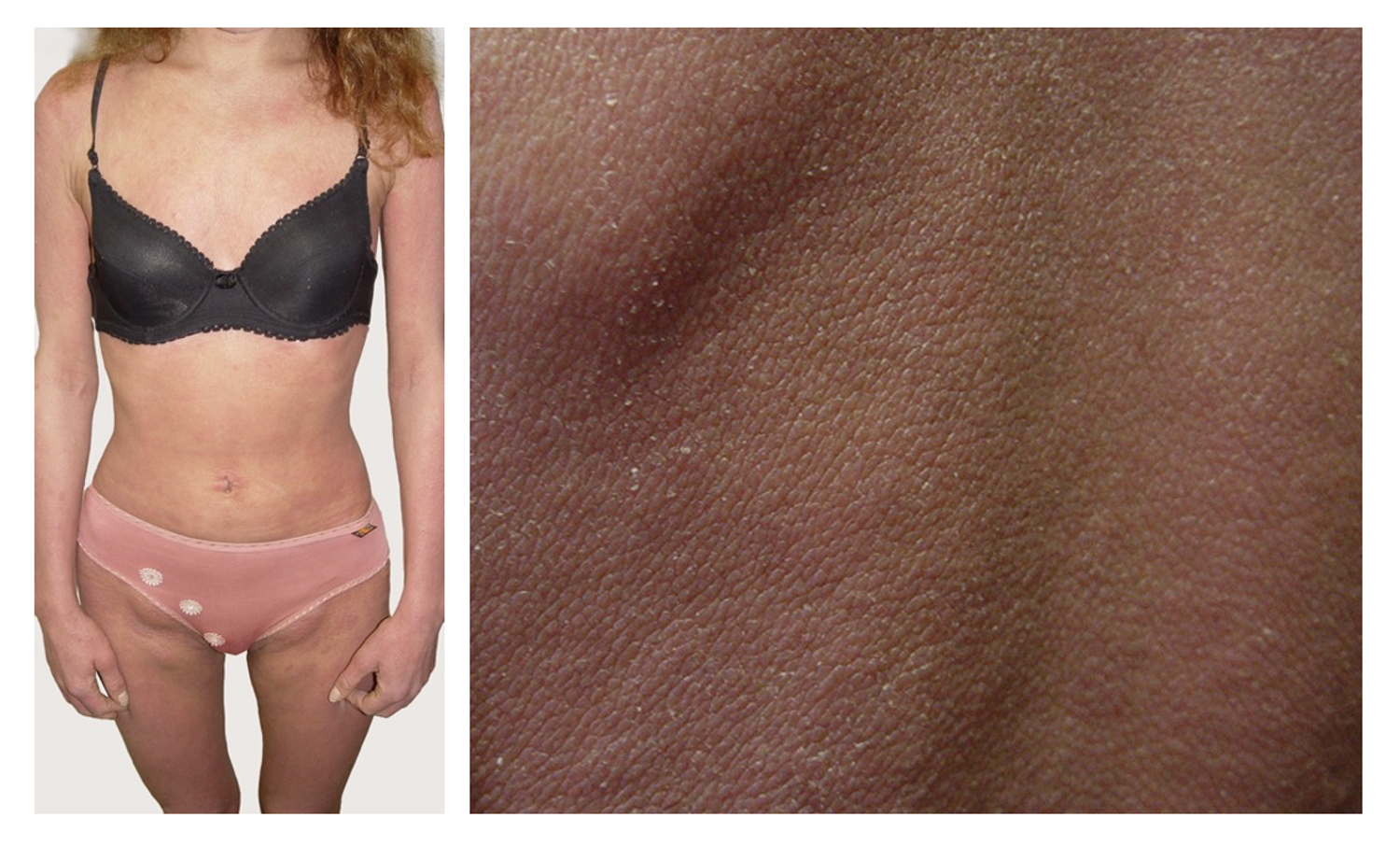
Рисунок 45. Клиническая демонстрация локального статуса пациентки Л., 26 лет, от 12 декабря 2014 г. № 11/2
На основании жалоб, анамнеза заболевания, клинической картины и результатов обследования поставлен диагноз: атопический дерматит, эритродермия, тяжелое течение.
Согласно клиническим рекомендациям по дерматологии «в сложных случаях при проведении дифференциального диагноза атопического дерматита проводят гистологическое исследование биоптатов кожи»58. Был взят биоптат кожи для оценки функциональных свойств клеток эпидермиса и дермы в очаге поражения (табл. 3). Учитывая, что очаг занимал всю площадь кожи, биоптат брался с верхненаружного квадранта правой ягодицы.
Таблица 3. Цитоиммунограмма кожи от 12 декабря 2014 г. № 11/2 пациентки Л., 26 лет, с диагнозом: атопический дерматит, эритродермия, тяжелое течение
|
Субпопуляции клеток кожи и жизнеспособность |
Фенотип |
Показатели, % |
|
Кератиноциты, из них активированные |
CD49f+ CD49f+ HLA-DR+ |
79,0 11,8 |
|
Фибробласты, из них активированные |
CD45– CD14– CD44+ CD45– CD14– CD44+ CD80+ |
51,0 34,2 |
|
Клетки Лангерганса, из них активированные |
CD207+ CD207+ CD80– HLA-DR+ CD207+ CD80+ HLA-DR– CD207+ CD80+ HLA-DR+ |
47,0 0 9,9 11,4 |
|
Эндотелиальные клетки, из них активированные |
CD146+ CD146+ CD54– HLA-DR+ CD146+ CD54+ HLA-DR– CD146+ CD54+ HLA-DR+ CD146+ CD34+ |
0,9 0 25,1 1,0 5,2 |
|
Тучные клетки, из них активированные |
CD249+ CD249+ CD63+ |
75,4 8,9 |
|
Моноциты, из них активированные |
CD45+ CD14+ CD45+ CD14+ HLA-DR+ |
6,9 1,0 |
|
Эпидермальные лимфоциты: Т-общие Т-хелперы Т-цитотоксические В-лимфоциты NK-клетки |
CD45+ CD3+ CD45+ CD3+ CD4+ CD8– CD45+ CD3+ CD4– CD8+ CD45+ CD3+ CD19+ CD45+ CD3– CD16+ CD56+ |
25,0 15,0 8,0 6,0 11,0 |
|
Жизнеспособность, % |
94 |
Полученные данные отражают выраженные признаки системного воспаления и иммунного дисбаланса на уровне клеточного фенотипа кожи. Несмотря на сохранность общей жизнеспособности клеток (94 %), выявлено значительное смещение фенотипического баланса в сторону активации воспалительных и антигенпрезентирующих субпопуляций при снижении регенераторного и супрессорного звеньев.
Далее представлен анализ субпопуляций клеток.
Кератиноциты (CD49f+ HLA-DR+). Доля кератиноцитов составляет 79 %, при этом повышено количество активированных форм (11,8 %), экспрессирующих HLA-DR. Это указывает на стресс-индуцированную активацию эпидермиса и нарушение барьерной функции кожи. Кератиноциты приобретают иммунную компетентность, участвуя в презентации антигенов и поддержании воспаления.
Фибробласты (CD45+ CD14– CD44+). Общая доля фибробластов – 51 %, из них 34,2 % активированы (CD44+ CD80+). Наблюдается выраженная гиперактивация дермального матрикса, что отражает попытку ткани компенсировать хроническое воспаление за счет усиленного синтеза внеклеточных структур и ремоделирования.
Клетки Лангерганса (CD207+). Их содержание – 47 %, при этом активно экспрессируются CD80+ HLA-DR+ фенотипы (около 11 %). Отмечается высокая антигенпрезентирующая активность и вовлеченность в каскад Th2-зависимого воспаления. Наличие трех функциональных подтипов (DR+/DR–, активированные и неактивированные) свидетельствует о разнонаправленной активации кожного иммунного надзора.
Эндотелиальные клетки (CD146+). Их доля относительно невелика (около 0,9 %), однако субпопуляции CD54+ HLA-DR– и CD34+ составляют 25,1 % и 5,2 % соответственно, что указывает на выраженное сосудистое участие в воспалительном процессе. Наблюдается активация эндотелия и формирование микроваскулярного воспалительного компонента – типично для эритродермии.
Тучные клетки (CD249+ CD63+). Общее количество – 75,4 %, из них 8,9 % активированы. Это говорит о высокой дегрануляционной активности мастоцитов, сопровождающейся высвобождением медиаторов воспаления (гистамина, триптазы), что клинически коррелирует с зудом, гиперемией и сосудистой реактивностью.
Моноциты (CD45+ CD14+ HLA-DR+). Общая доля – 6,9 %, активированные формы – 1,0 %. Умеренная инфильтрация макрофагального ряда, отражающая хронический, относительно стабильный характер воспаления, без выраженного острого всплеска.
Эпидермальные лимфоциты:
Иммунный профиль кожи Th2-доминантный, с умеренным увеличением NK-клеток, что указывает на включение врожденного иммунного звена. Сохраняется относительный баланс Th/CD8 (≈ 1,9), но со смещением в сторону хелперной активности, типичной для атопических состояний.
Интерпретация данного фенотипа. Полученная цитоиммунограмма соответствует высокоактивному воспалительному фенотипу кожи, характеризующемуся:
Такой фенотип ассоциирован с хроническим течением атопического дерматита в фазе обострения, осложненным эритродермией.
Практическое значение данного наблюдения заключается в определении начального фенотипа клеток в воспалительном инфильтрате кожи для дальнейшей оценки эффективности проводимой терапии в стационаре: метилпреднизолон 250 мг внутривенно на 200 мл физиологического раствора, № 5; натрия тиосульфат 30 % – 10 мл внутривенно, ежедневно, № 15; кальция глюконат 10 % – 10 мл внутримышечно, ежедневно, № 15; пипольфен 25 мг 1 раз в сутки, 5 дней; затем тавегил 1 мг 3 раза в день, 10 дней; топическая терапия мометазона фуроатом, эмолентами и орошение расчесов раствором хлоргексидина биглюконата 0,05 %. Клинический эффект от проводимого лечения был значительный, он проявился снижением зуда и уменьшением инфильтрации кожи.
Выявлено, что при рассмотрении субпопуляций тучных клеток кожи до лечения и спустя 1,5 месяца от начала лечения наблюдалось фактическое снижение количества активированных форм данных клеток (фенотип CD249+ CD63+) в очаге воспаления (рис. 46).
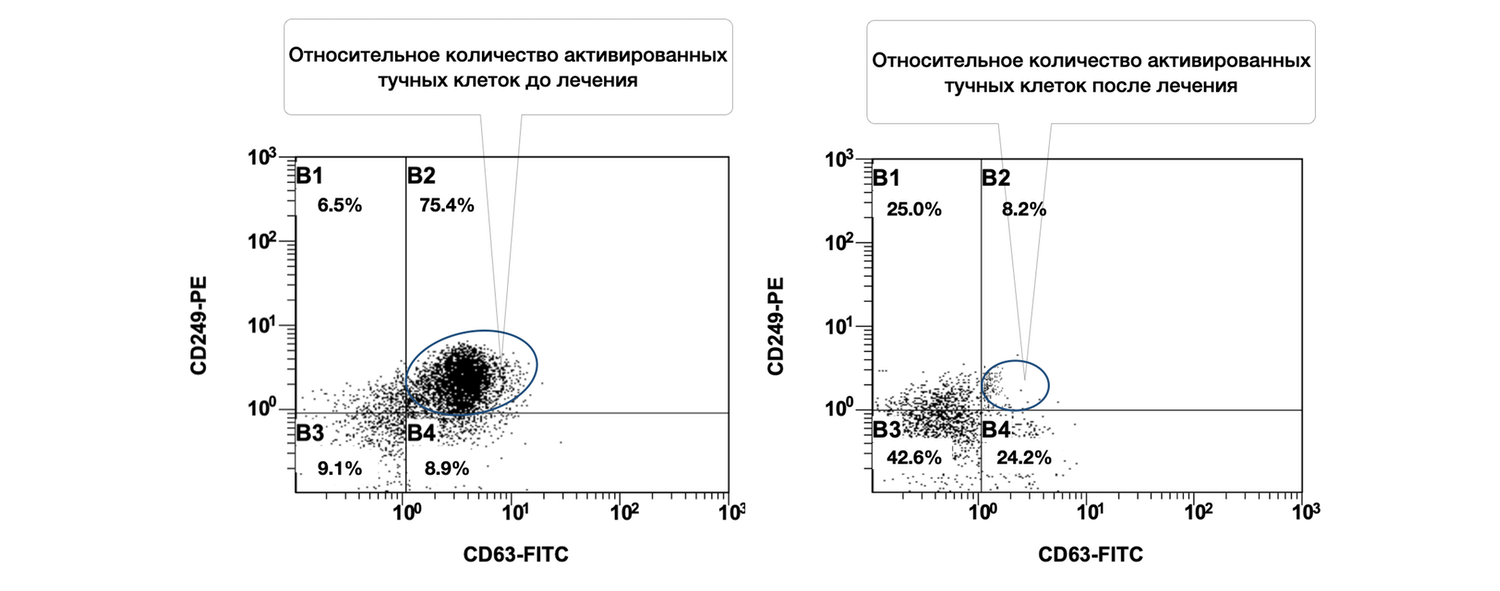
Рисунок 46. Сравнительная характеристика относительного количества жизнеспособных активированных тучных клеток (фенотип CD249+ CD63+) в суспензии клеток биоптата кожи пациентки Л., 26 лет, от 12 декабря 2014 г. № 11/2 и от 25 января 2015 г. № 11/5
Сравнительная характеристика относительного количества жизнеспособных активированных тучных клеток (фенотип CD249+ CD63+) в клеточной суспензии биоптата кожи у данной пациентки, до и после лечения, на основе предоставленных диаграмм звучит следующим образом.
Фенотипируемая популяция: CD249⁺ CD63⁺. Жизнеспособные активированные тучные клетки (mast cells), определяемые по экспрессии двух маркеров:
CD249 (p75/NGFR) — поверхностный маркер жизнеспособных тучных клеток;
CD63 — маркер активации, ассоциированный с дегрануляцией и выбросом медиаторов воспаления (гистамина, триптазы и др.).
Сравнение по данным диаграмм:
|
Состояние |
% CD249⁺CD63⁺ (B2) |
Интерпретация |
|---|---|---|
|
До лечения |
75.4% |
Крайне высокая доля активированных тучных клеток — более ¾ всей популяции. Указывает на выраженную локальную воспалительную реакцию. |
|
После лечения |
8.2% |
Существенное снижение активации. Менее 1/10 тучных клеток остаются активными. |
Динамика: активация тучных клеток снизилась в 9,2 раза (с 75.4% до 8.2%). Такая выраженная редукция свидетельствует об эффективности проведённой терапии, направленной на стабилизацию мастоцитарной активности, уменьшение дегрануляции и купирование воспалительного компонента. Дополнительные наблюдения из диаграммы:
B3-сектор (CD249⁻ CD63⁻) — "неспецифические" или неидентифицированные клетки:
До лечения: 9.1%
После лечения: 42.6% (рост почти в 5 раз)
Возможно, часть клеток «перешла» в неактивное состояние.
B4-сектор (CD249⁺ CD63⁻) — жизнеспособные, но неактивированные тучные клетки:
До лечения: 8.9%
После лечения: 24.2% (рост в 2,7 раза)
Это подтверждает, что лечение сохранило жизнеспособность тучных клеток, но успешно подавило их активацию.
Таким образом, у данной пациентки на момент начала лечения наблюдался высокий уровень воспалительной активации тучных клеток в коже. На фоне терапии произошло многократное снижение количества CD63⁺ активированных мастоцитов, при одновременном увеличении доли неактивированных жизнеспособных форм. Это демонстрирует не только клиническую, но и иммуноцитологическую эффективность лечения.
Расширение возможностей проточной цитометрии до практического использования в дерматологии значительно увеличивает не только точность оценки диагностически значимых моментов, поскольку обеспечивает многопараметрический анализ клеток кожи с достоверностью только в одной пробе одного пациента, но и позволяет проводить эту оценку в динамике наблюдений. Как это было отмечено нами до лечения, через месяц и после лечения, когда наблюдалось фактическое снижение количества активированных форм фибробластов (фенотип CD45– СD14– CD44+) в очаге воспаления у данной пациентки (рис. 47).
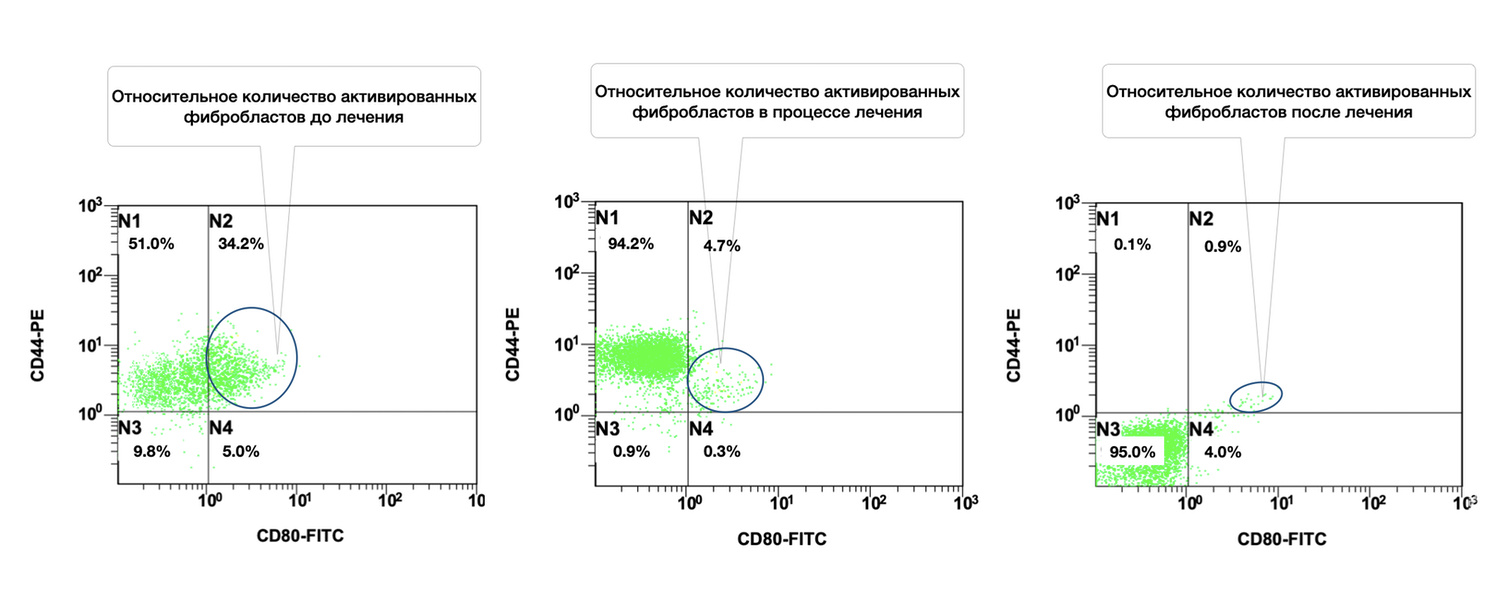
Рисунок 47. Сравнительная характеристика относительного количества жизнеспособных активированных фибробластов (фенотип CD45– СD14– CD44+) в суспензии клеток биоптата кожи пациентки Л., 26 лет, от 12 декабря 2014 г. № 11/2, от 10 января 2015 г. № 11/4 и от 25 января 2015 г. № 11/5
Сравнительная характеристика относительного количества жизнеспособных активированных фибробластов (фенотип: CD45⁻ CD14⁻ CD44⁺ CD80⁺) в клеточной суспензии биоптата кожи у данной пациентки на разных этапах терапии выглядит следующим образом.
Фенотипируемая популяция:
Фибробласты: CD45⁻ CD14⁻ (отрицание иммунных клеток) + CD44⁺ (мезенхимальный маркер клеточной адгезии и миграции);
Активация фибробластов: CD80⁺ (ко-стимулирующий молекулярный маркер, обычно ассоциированный с иммунной активацией, реже — с фибробластной реакцией в условиях воспаления/фиброза).
Данные по диаграммам (по сектору N2: CD44⁺ CD80⁺):
|
Этап исследования |
% активированных фибробластов (CD44⁺CD80⁺) |
Интерпретация |
|---|---|---|
|
До лечения |
34.2% |
Повышенное количество активированных фибробластов. Свидетельствует о наличии активного воспалительно-фиброзного процесса в дерме. |
|
Во время лечения |
4.7% |
Существенное снижение активации. Быстрое начало регресса воспалительного сигнала. |
|
После лечения |
0.9% |
Почти полное отсутствие признаков активации. Нормализованное фибробластное звено кожи. |
Динамика активации:
Снижение в 7,3 раза уже на стадии лечения (34.2% → 4.7%);
Финальное снижение в 38 раз от исходного уровня (34.2% → 0.9%);
Резкое угасание активности указывает на выраженное противовоспалительное и репаративное действие терапии.
Дополнительные наблюдения:
Популяция N1 (CD44⁺ CD80⁻):
До лечения: 51.0%
Во время лечения: 94.2%
После лечения: 0.1%
Это отражает, что на стадии лечения происходит временная экспансия "неактивированных, но жизнеспособных" фибробластов, после чего эта популяция также редуцируется.
Популяция N3 (CD44⁻ CD80⁻):
После лечения: 95.0%
Преобладание N3 в финале отражает возвращение клеточного состава к норме.
Таким образом, у данной больной изначально наблюдалась высокая активация фибробластов, вероятно обусловленная воспалительным повреждением кожи. Проведенное лечение привело к почти полной редукции активационного фенотипа CD44⁺CD80⁺, что указывает на успешное подавление фиброзного каскада, стабилизацию внеклеточного матрикса и завершение фазы репарации.
Сведения о состоянии кератиноцитов (фенотип CD49+ HLA-DR+) из инфильтратов до лечения, в процессе и после лечения конкретно этой больной можно увидеть на рис. 48.
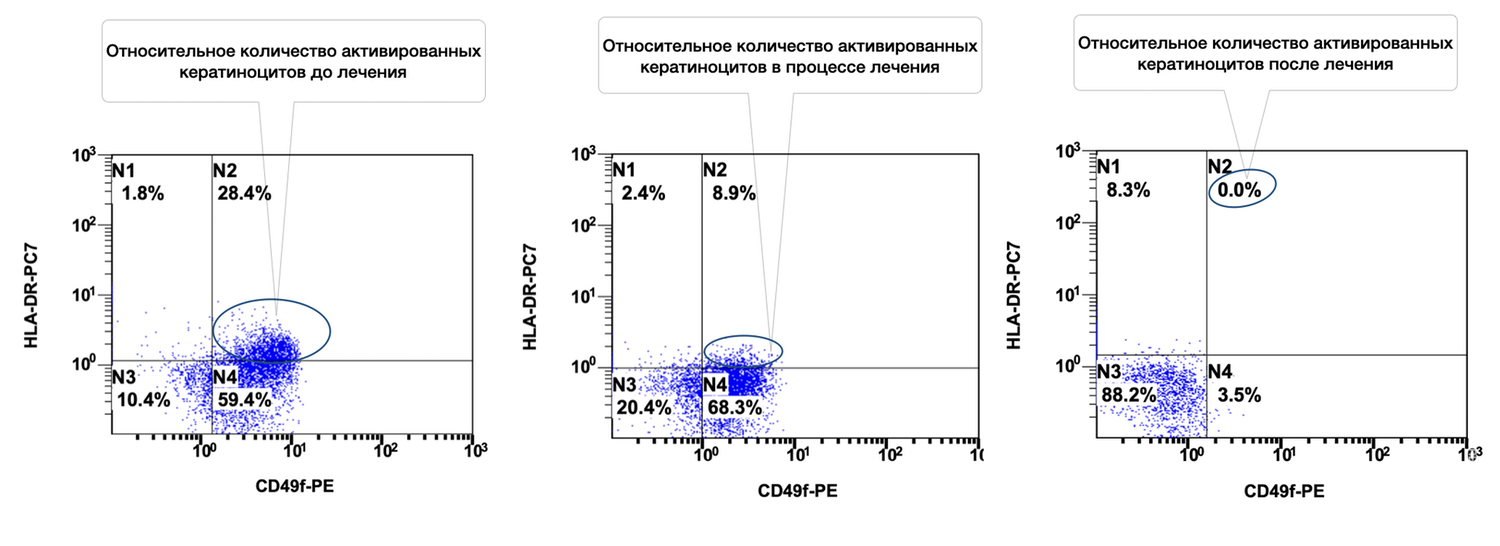
Рисунок 48. Сравнительная характеристика относительного количества жизнеспособных активированных кератиноцитов (фенотип CD49+ HLA-DR+) в суспензии клеток биоптата кожи пациентки Л., 26 лет, от 12 декабря 2014 г. № 11/2, от 10 января 2015 г. № 11/4 и от 25 января 2015 г. № 11/5
На представленных диаграммах показана динамика относительного количества жизнеспособных активированных кератиноцитов (фенотип CD49f⁺ HLA-DR⁺) в суспензии клеток биоптата кожи пациентки до, во время и после лечения, на основе данных проточной цитометрии, сравнительный анализ (CD49f⁺ HLA-DR⁺, зона N2):
|
Этап наблюдения |
% Активированных кератиноцитов |
|---|---|
|
До лечения |
28.4% |
|
Во время лечения |
8.9% |
|
После лечения |
0.0% |
Интерпретация:
До лечения — зафиксировано высокое количество активированных кератиноцитов (28.4%), что свидетельствует о наличии выраженной эпидермальной активации и иммунного стресса кожи.
В процессе лечения — наблюдается значительное снижение уровня активации до 8.9%, что указывает на положительную реакцию тканей на терапию и уменьшение воспалительного ответа.
После лечения — активированные кератиноциты полностью отсутствуют (0.0%), что может свидетельствовать о полном восстановлении физиологического состояния эпидермиса, нормализации иммунного баланса и завершении активной воспалительной фазы.
Таким образом, снижение относительного количества активированных кератиноцитов (CD49f⁺ HLA-DR⁺) с 28.4% до 0.0% на фоне лечения демонстрирует чёткий противовоспалительный эффект и восстановление нормального фенотипического статуса клеток эпидермиса. Это отражает высокую эффективность проведённой терапии и позволяет рассматривать данный показатель как надёжный биомаркер воспалительной активности кератиноцитов.
Данные сведения были сопоставимы с положительной динамикой индекса SCORAD – 41 балл через месяц от начала лечения (исходно – 82) и 29 баллов спустя три недели ото дня госпитализации, что как минимум объективно свидетельствует об эффективности проведенной терапии. Пациентка была выписана из стационара на амбулаторное долечивание.
Этим примером показана эффективность применения способа оценки фенотипического состава клеток кожи у взрослых для прецизионной диагностики атопического дерматита, а также использование цитоиммунограмм кожи как отправной точки состояния клеток кожи воспалительного инфильтрата до лечения, в его процессе и по достижении клинической ремиссии в качестве дополнительных (к визуальным и субъективным) критериев результативности терапии.
Больная М., 57 лет, обратилась в Тюменский ОКВД с жалобами на наличие и появление пузырей на коже туловища и конечностей, сопровождаемых слабовыраженным зудом в вечернее время. Больной себя считает в течение полугода, когда без явной причины заметила образование пузырьков в полости рта. Значения им не придала.
Спустя месяц, на фоне ухудшения общего самочувствия, заметила появление зуда, красных пятен и мелких пузырьков с мутным содержимым на туловище и в подмышечных областях. Самостоятельно применяла «различные мази из домашней аптечки», но новые высыпания появились на груди и спине, их размер стремительно увеличивался. Анамнез жизни, наследственный и аллергоанамнез без особенностей. Прием антибиотиков отрицает.
При обращении в поликлинику ОКВД был выставлен клинический диагноз: пузырчатка вульгарная? пузырчатка листовидная? герпетиформный дерматит Дюринга?
В связи с распространенностью и тяжестью течения патологического процесса больная была госпитализирована в стационар Тюменского ОКВД, где было назначено исследование мазков-отпечатков на акантолитические клетки и проведение диагностической биопсии кожи спины (из краевой области эрозивной поверхности).
При поступлении состояние тяжелой степени. Пациентка гиперстенической конституции. Ожирение III степени. Аускультативно дыхание везикулярное, отмечалось наличие влажных хрипов. ЧДД 20 в минуту. Тоны сердца ясные, ритмичные, ЧСС 88 в минуту, артериальное давление 140/90 мм рт. ст. Язык сухой, с белым налетом по бокам языка. Живот мягкий, безболезненный при пальпации. Печень увеличена на 2 см по нижнему краю, селезенка не увеличена. Стул не регулярный, есть склонность к запорам. Симптом поколачивания отрицательный с обеих сторон. Мочеиспускание безболезненное. Щитовидная железа визуально не увеличена, пальпация ее безболезненная.
Патологический процесс при поступлении носил распространенный характер на коже туловища, верхних и нижних конечностей, был представлен множественными округлыми, эритематозно-сквамозными очагами розового и красного цветов с редкими пятнами гиперпигментации коричневого цвета. На поверхности очагов поражения, преимущественно в области спины и груди, отмечалось наличие сгруппированных пузырьков с серозным содержимым на гиперемированном фоне, до 1 см в диаметре, с плотной и напряженной покрышкой и серозным содержимым. На коже туловища, боковых поверхностей, коже ягодиц и поясницы, коже конечностей определялись сливающиеся в обширные очаги эрозии, на поверхности которых обнаруживались корочки и чешуйки. Феномен Никольского положительный. Придатки кожи в процесс не были вовлечены. В полости рта отмечено наличие эрозий и язв с белым налетом, болезненных при надавливании шпателем.
По результатам комплексного клинико-лабораторного обследования у больной был выявлен положительный мазок-отпечаток на акантолитические клетки, в периферической крови лейкоцитоз составил 14,4×109/л; лимфопения 1,19 тыс./мкл; уровень аланинаминотрансферазы 69 ед./л; нРИФ с антителами к IgG, IgA, IgM в биоптате видимо не пораженной кожи наблюдалась выраженная фиксация IgG в межклеточных промежутках всех слоев эпидермиса, фиксации IgA и IgG в структурах кожи не обнаружено.
Эти сведения легли в основу диагноза: Пузырчатка вульгарная, тяжелая степень течения. PDAI – 190 баллов (рис. 49).
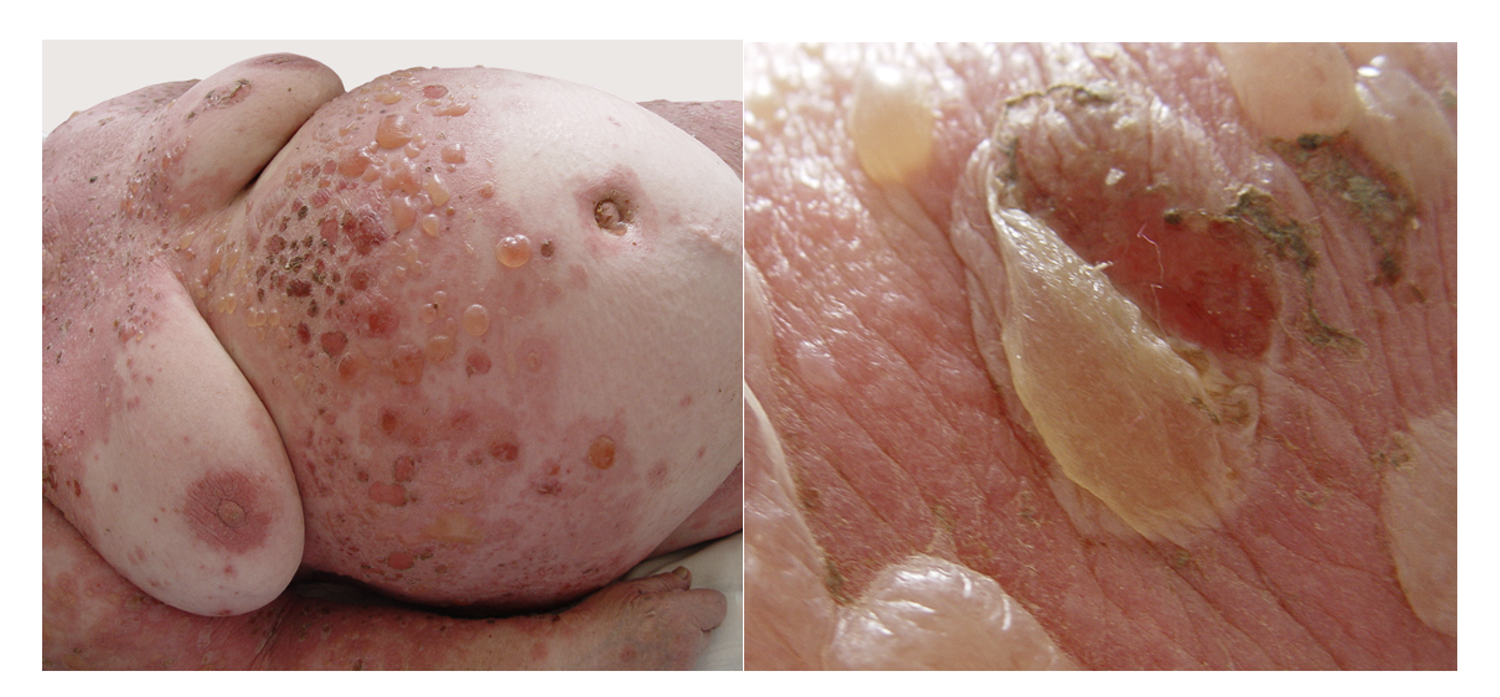
Рисунок 49. Клиническая демонстрация локального статуса пациентки М., 57 лет, от 12 ноября 2016 г.
В условиях стационара было проведено лечение преднизолоном 100 мг в сутки (из расчета 1 мг на кг массы тела) в течение всего периода стационарного лечении – 15 дней, с последующим снижением дозы на треть сразу и титрованием по 5 мг отмены в неделю; эссенциальные фосфолипиды по 5 мл в/в струйно, № 10; панангин по 1 таблетке 3 раза в сутки; кальций Д3 по 1 таблетке 3 раза в сутки; омепразол по 1 капсуле 20 мг 2 раза в сутки; наружная терапия мазью мометазона фуроат и орошение раствором метиленового синего.
Одновременно демонстрируется цитоиммунограмма кожи краевой зоны эрозий (табл. 4).
Таблица 4. Цитоиммунограмма кожи больной М., 57 лет, от 12 ноября 2016 г. № 138/4
|
Субпопуляции клеток кожи и жизнеспособность |
Фенотип |
Показатели, % |
|
Кератиноциты, из них активированные |
CD49f+ CD49f+ HLA-DR+ |
41,2 29,7 |
|
Фибробласты, из них активированные |
CD45– CD14– CD44+ CD45– CD14– CD44+ CD80+ |
54 0,6 |
|
Клетки Лангерганса, из них активированные |
CD207+ CD207+ CD80– HLA-DR+ CD207+ CD80+ HLA-DR– CD207+ CD80+ HLA-DR+ |
57 23,9 7,0 0,5 |
|
Эндотелиальные клетки, из них активированные |
CD146+ CD146+ CD54– HLA-DR+ CD146+ CD54+ HLA-DR– CD146+ CD54+ HLA-DR+ CD146+ CD34+ |
0,9 4,2 12,5 0 0,2 |
|
Тучные клетки, из них активированные |
CD249+ CD249+ CD63+ |
2,6 1,9 |
|
Моноциты, из них активированные |
CD45+ CD14+ CD45+ CD14+ HLA-DR+ |
4,0 2,5 |
|
Эпидермальные лимфоциты: Т-общие Т-хелперы Т-цитотоксические В-лимфоциты NK-клетки |
CD45+ CD3+ CD45+ CD3+ CD4+ CD8– CD45+ CD3+ CD4– CD8+ CD45+ CD3+ CD19+ CD45+ CD3– CD16+ CD56+ |
15 11 2 5 14 |
|
Жизнеспособность, % |
92 |
Клеточная суспензия, полученная из биоптата краевой зоны эрозии: жизнеспособность клеток – 92 %, что обеспечивает достоверность фенотипирования. Профиль цитоиммунограммы отражает аутоиммунный воспалительный фенотип, характеризующийся сочетанием эпидермальной гиперактивации, высокой антигенпрезентирующей активности, сосудистого компонента воспаления и умеренного участия врожденного иммунитета. Фенотип соответствует активной фазе аутоиммунного процесса с очаговой регенераторной компенсацией.
Ниже дан анализ субпопуляций клеток.
Кератиноциты (CD49f+ HLA-DR+) составляют 41,2 % популяции при высоком уровне активации – 29,7 %. Данные указывают на глубокую активацию эпидермиса, связанную с аутоиммунной атакой на десмосомальные белки (в частности, десмоглеины). Экспрессия HLA-DR на кератиноцитах свидетельствует о вовлечении их в антигенпрезентирующую функцию – ключевой механизм патогенеза пузырчатки, способствующий поддержанию локального аутоиммунного ответа.
Фибробласты (CD45– CD14– CD44+) составляют 54 %, активированные формы – 0,6 %. Низкая активация указывает на подавление репаративных механизмов в зоне поражения, вероятно, вследствие постоянного воспалительного давления и токсического воздействия аутоантител. Тем не менее сохранение общей доли фибробластов выше нормы отражает готовность ткани к регенерации при снятии воспалительного стимула.
Клетки Лангерганса (CD207+). Суммарное количество – 57 %, при этом активированные формы (CD80+ HLA-DR+) достигают 23,9 %, что является выраженным показателем гиперактивации антигенпрезентирующего звена. Наблюдается многополюсное распределение по фенотипам (DR+/DR–), что соответствует неоднородности иммунного ответа в пределах краевой зоны эрозий: сочетание активных антигенпрезентирующих клеток и клеток, находящихся в стадии истощения. Это типично для аутоиммунных процессов с цикличностью активности.
Эндотелиальные клетки (CD146+ CD54+ CD34+). Совокупная доля – 17,8 %, при этом CD54+ HLA-DR– составляют 12,5 %. Данный профиль отражает высокую сосудистую проницаемость и эндотелиальную активацию, что клинически проявляется экссудацией и формированием пузырей. Минимальное присутствие CD34+ (0,2 %) – признак ограниченного ангиогенеза, что объясняет замедленную эпителизацию эрозий.
Тучные клетки (CD249+ CD63+). Количество – 2,6 %, активированные – 1,9 %. Отмечается умеренная дегрануляция мастоцитов, поддерживающая воспаление через высвобождение гистамина, триптазы и TNF-α. Такое соотношение типично для хронического, неострого течения пузырчатки.
Моноциты (CD45+ CD14+ HLA-DR+). Общая доля – 4 %, активированные – 2,5 %. Отражает локальную макрофагальную инфильтрацию и активацию фагоцитарного звена, обеспечивающего клиренс аутоантител и клеточных остатков. Присутствие HLA-DR+ моноцитов подчеркивает участие этого звена в антиген-презентации и поддержании аутоиммунной реакции.
Эпидермальные лимфоциты:
Иммунный профиль характеризуется доминированием Th-звена (CD4+) при низком уровне цитотоксических Т-клеток (CD8+), что типично для аутоантителозависимого воспаления. Высокое содержание NK-клеток (14 %) отражает включение врожденного иммунного звена в ответ на разрушение эпидермиса и образование пузырей.
Фенотипическая картина указывает на аутоиммунно-воспалительный тип повреждения с эпидермальной гиперактивацией, выраженной антиген-презентацией и вовлечением сосудистого эндотелия. Одновременно наблюдается умеренная репаративная тенденция (активация CD14+ HLA-DR+ и присутствие CD34+ клеток), что позволяет отнести фенотип к переходному типу – воспалительно-регенераторному.
Цитоиммунограмма кожи пациентки М. отражает активный аутоиммунный воспалительный фенотип, типичный для пузырчатки вульгарной:
Клинико-фенотипическое значение: профиль соответствует активной фазе пузырчатки в зоне эрозий. При терапии, направленной на снижение антиген-презентации и восстановление межклеточных связей, ожидается переход к ремиссионному типу цитоиммунограммы кожи (ЦИГК).
В представленном примере констатируется факт количественного и функционального состояния клеток основных субпопуляций кожи, причем у конкретной пациентки, с ее уникальными особенностями кожи и всего организма. Фактически фотография сыпи информирует о локальном статусе, но не содержит информации о состоянии клеток, формирующих наблюдаемые элементы сыпи. Между тем выбор метода дозы ГКС при лечении пузырчатки, согласно рекомендациям, зависит от степени выраженности и локализации клинических проявлений, формы и длительности заболевания, сведений об эффективности ранее проводимой терапии.
Стало быть, это определяется субъективным восприятием и опытом дерматолога, а не объективной количественно-функциональной характеристикой клеток кожи пациента. Очевидно, это связано с тем, что наружная и системная терапия универсальны и не учитывают разницы фактического состояния клеток кожи у одного, отдельно взятого пациента. А ведь она есть.
Так, только по одному показателю цитоиммунограммы кожи можно проследить, что количество кератиноцитов (CD49f+) в биоптате из инфильтрата кожи больной составляло 41,2 %, из них активированных (CD49f+ HLA-DR+) 29,7 %, а после лечения согласно Федеральным клиническим рекомендациям по дерматологии (2016) – 59,6 % и 37,0 соответственно (рис. 50).
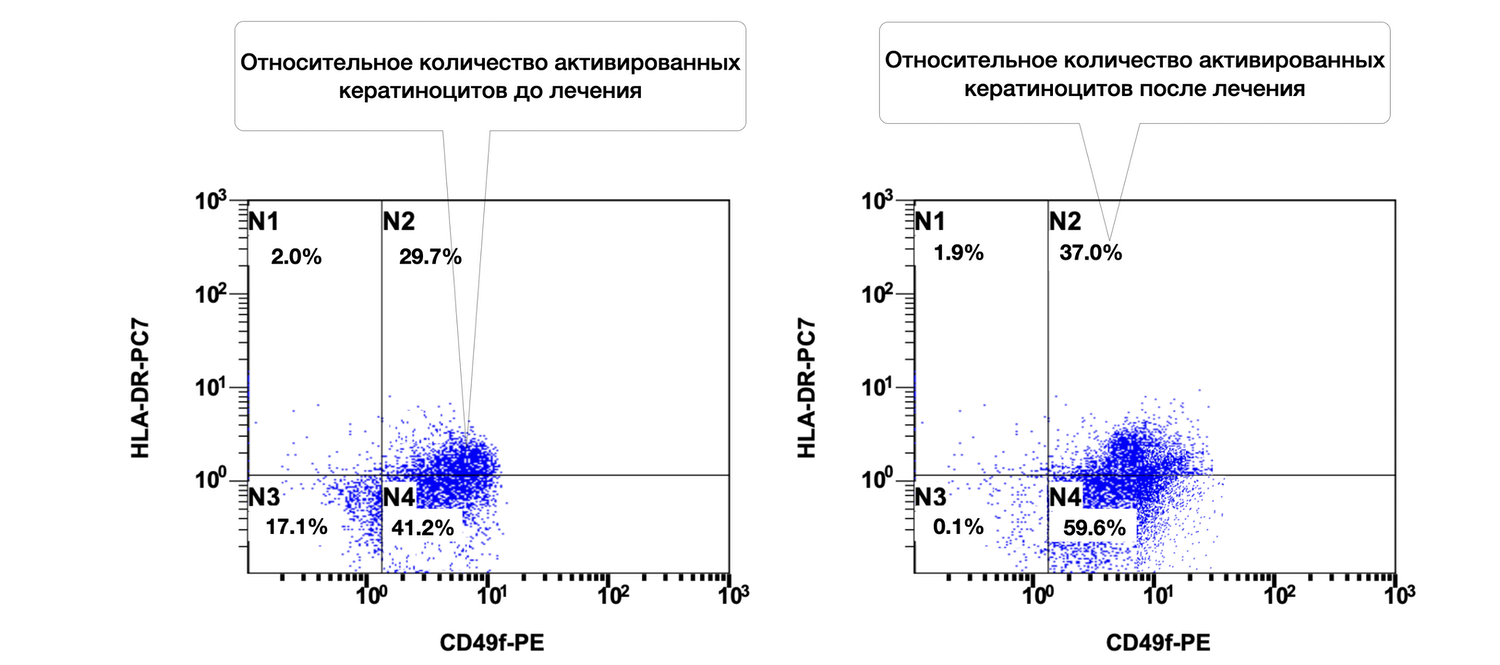
Рисунок 50. Сравнительная характеристика относительного количества жизнеспособных активированных кератиноцитов (фенотип CD49f+ HLA-DR+) в суспензии клеток биоптата кожи больной М., 57 лет, от 12 ноября 2016 г. № 138/4 и 27 ноября 2016 г. № 138/5
Описание сравнительной характеристики относительного количества жизнеспособных активированных кератиноцитов (фенотип CD49f+ HLA-DR+) в клеточной суспензии кожного биоптата у пациентки М. на основании предоставленных диаграмм до и после лечения звучит так:
Дополнительные наблюдения:
В отличие от предыдущего случая, у этой больной относительное количество активированных кератиноцитов не уменьшилось, а возросло на фоне лечения (с 29.7% до 37.0%). Это требует комплексной оценки клинической картины: увеличение экспрессии HLA-DR может быть как негативным (признак персистирующего воспаления), так и нейтральным/положительным (отражающим активную регенерацию). В данном случае, может быть рекомендовано сопоставление с клиническими данными, уровнями воспалительных цитокинов, морфологией и общим ответом на терапию.
Предлагаемый способ оценки цитоиммунограмм кожи является не только решением важной задачи с точки зрения научных изысканий, но и позволяет дерматологу получить объективную информацию о наличии аутоиммунного процесса в коже пациента и учитывать эти результаты в качестве дополнительного диагностического критерия, а также средства повышения эффективности контроля проводимого лечения. Как и при большинстве других заболеваний кожи, гистологическое исследование биоптатов кожи часто проводится с целью дифференциальной диагностики. Но не для подбора лечения, что странно, ведь цитоиммунограмма кожи позволяет добавить к данному описанию еще и функциональную характеристику клеток кожи, особенно необходимую для оценки состояния кожи.
При выписке из стационара у больной отмечалась положительная динамика в виде регресса большинства высыпаний с формированием остаточной гиперпигментации. На коже туловища, верхних и нижних конечностей отмечалось наличие единичных, плотно прилегающих, сухих корок. Больная была выписана с клиническим улучшением на долечивание в амбулаторных условиях. Даны рекомендации продолжить прием преднизолона в дозе 70 мг в сутки с последующим решением вопроса о снижении суточной дозы принимаемого препарата с учетом клинико-лабораторных данных и под наблюдением дерматолога по месту жительства. Также был рекомендован прием гепатопротекторов, ингибиторов протонного насоса, препаратов калия и магния, регулятора кальциево-фосфорного обмена. Объективно это сопровождалось снижением количества активированных внутриэпидермальных макрофагов (CD207+ HLA-DR+) в цитоиммунограммах от 12 ноября 2016 г. (начало лечения) и 27 ноября 2016 г. (на момент первичного снижения дозы преднизолона со 100 мг в сутки до 70 мг) (рис. 51).
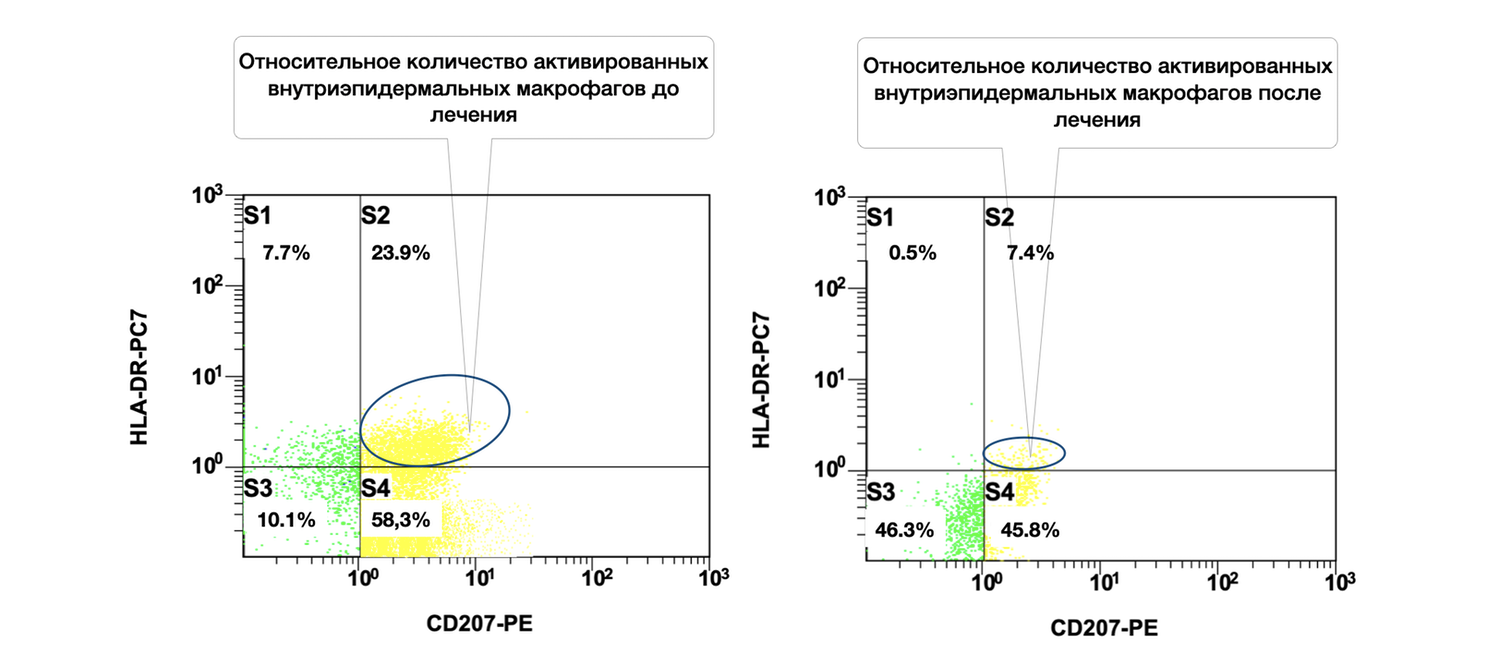
Рисунок 51. Сравнительная характеристика относительного количества активированных внутриэпидермальных макрофагов (фенотип CD207+ HLA-DR+) в суспензии клеток биоптата кожи больной М., 57 лет, от 12 ноября 2016 г. № 138/4 и 27 ноября 2016 г. № 138/5
Сравнительная характеристика относительного количества активированных внутриэпидермальных макрофагов (фенотип CD207+ HLA-DR+) в клеточной суспензии кожного биоптата этой пациентки до и после лечения на основе предоставленных цитоиммунограмм выглядит следующим образом.
Дополнительные зоны:
В итоге у пациентки отмечено значительное уменьшение доли активированных внутриэпидермальных макрофагов CD207+ HLA-DR+ после лечения (23,9 % → 7,4 %). Это может свидетельствовать об эффективности терапии, направленной на модуляцию иммунного ответа в коже и улучшение гомеостаза эпидермального иммунного микроокружения.
Спустя два месяца после стационарного лечения суточная доза преднизолона была уменьшена с 70 до 30 мг в сутки. Однако единичные эрозии сохранялись, что требовало стимуляции репаративных процессов, а в цитоиммунограмме кожи отмечался структурно-функциональный дефицит репаративного потенциала, определяемого уровнем эндотелиальных клеток (рис. 52).
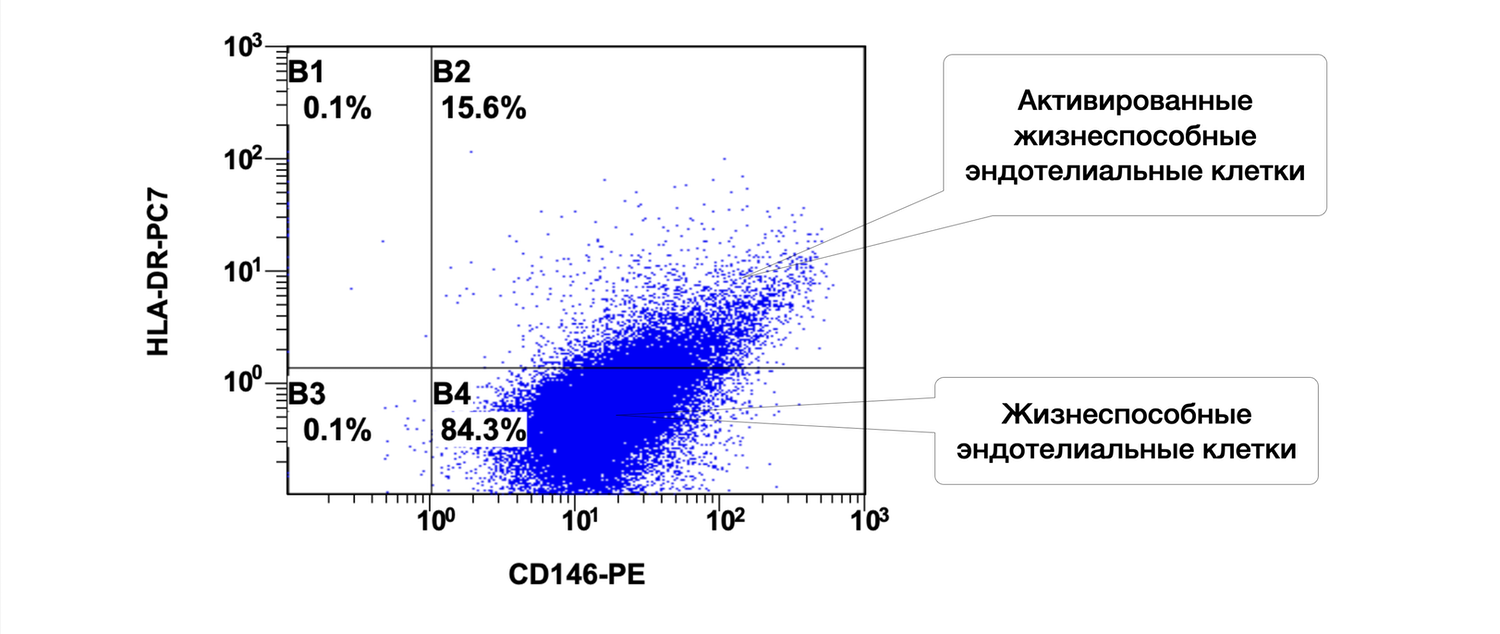
Рисунок 52. Сравнительная характеристика относительного количества жизнеспособных эндотелиальных клеток (фенотип CD146+ HLA-DR+) в суспензии клеток биоптата кожи больной М., 57 лет, от 27 ноября 2016 г. № 138/5
Ниже представлено итоговое описание состояния жизнеспособных эндотелиальных клеток (фенотип CD146+) и их активированных форм (фенотип CD146+ HLA-DR+) у пациентки после лечения на основе предоставленного анализа методом проточной цитометрии.
После проведенного лечения у пациентки сохраняется высокая доля жизнеспособных эндотелиальных клеток (99,9 %), из которых только 15,6 % демонстрируют признаки активации. Это указывает на восстановление микроциркуляторного русла, уменьшение сосудистой активации, а также на нормализацию местного кожного иммунного фона. В совокупности такие изменения свидетельствуют о положительной динамике и эффективности терапии.
Эти обстоятельства можгут служить основанием к назначению средств с доказанным эффектом стимулирующего воздействия на пролиферацию клеток во вторую и третью фазы ранозаживления.
Клинические рекомендации по специальности «дерматовенерология» предлагают дерматологам диагностировать красный плоский лишай согласно критериям, наблюдаемым при визуальном осмотре сыпи: «Поражение кожи при типичной форме красного плоского лишая характеризуется плоскими папулами диаметром 2–5 мм с полигональными очертаниями, с вдавлением в центре, розовато-красного цвета с характерным фиолетовым или сиреневатым оттенком и восковидным блеском, более отчетливым при боковом освещении. Шелушение обычно незначительное, чешуйки отделяются с трудом. На поверхности более крупных узелков, особенно после смазывания маслом, можно обнаружить сетевидный рисунок (симптом сетки Уикхема). Характерным признаком красного плоского лишая является склонность к сгруппированному расположению высыпаний с образованием колец, гирлянд, линий. Реже узелки сливаются, образуя бляшки с шагреневой поверхностью. Вокруг бляшек могут возникать новые папулы, располагающиеся более или менее густо. В большинстве случаев сыпь локализуется симметрично на сгибательных поверхностях конечностей, туловище, половых органах, довольно часто – на слизистой оболочке полости рта. Редко поражаются ладони, подошвы, лицо. Субъективно больных беспокоит зуд. В период обострения наблюдается положительный феномен Кебнера – появление новых узелков на месте травматизации кожи…»59
Пациентка обратилась с характерной клинической картиной (рис. 53).
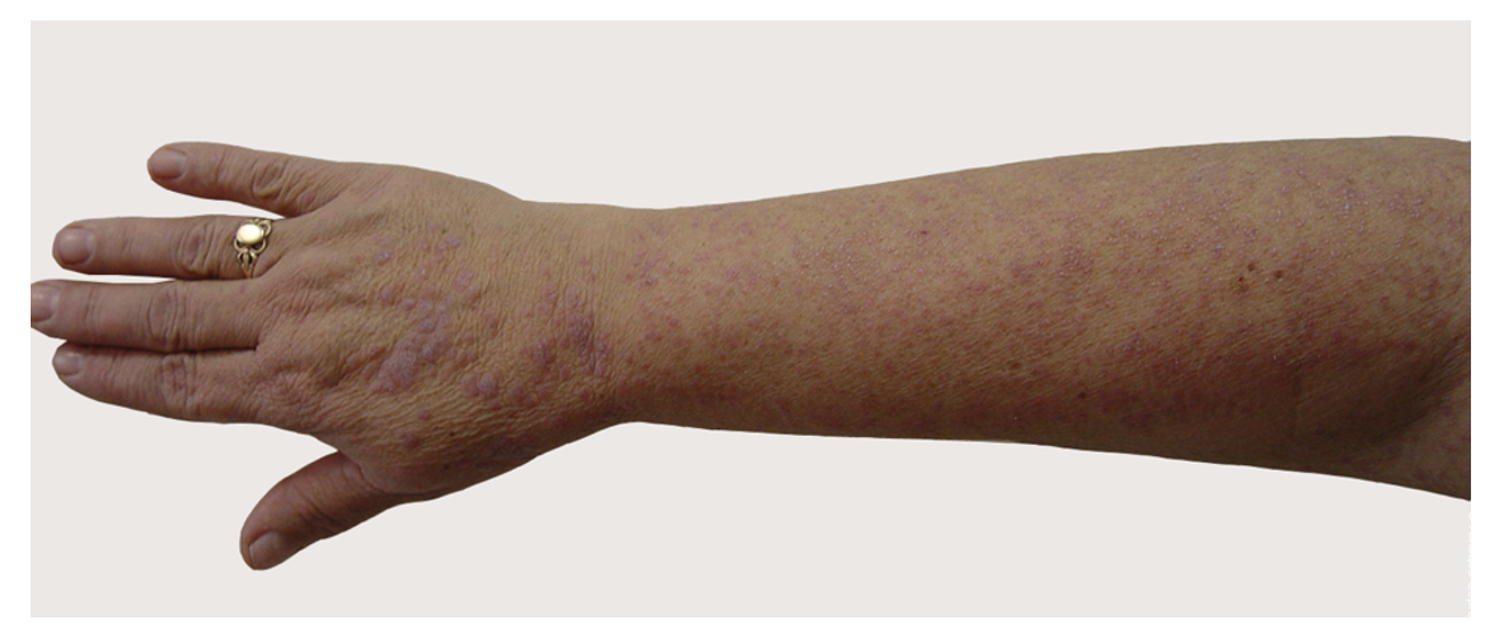
Рисунок 53. Клиническая демонстрация локального статуса пациентки Л., 52 года, от 12 ноября 2016 г.
Одновременно представляется цитоиммунограмма инфильтратов кожи данной пациентки (табл. 5).
Таблица 5. Цитоиммунограмма кожи пациентки Л., 52 года, от 12 ноября 2016 г. № 138/4
|
Субпопуляции клеток кожи и жизнеспособность |
Фенотип |
Показатели, % |
|
Кератиноциты, из них активированные |
CD49f+ CD49f+ HLA-DR+ |
41 29,7 |
|
Фибробласты, из них активированные |
CD45– CD14– CD44+ CD45– CD14– CD44+ CD80+ |
54 0,6 |
|
Клетки Лангерганса, из них активированные |
CD207+ CD207+ CD80– HLA-DR+ CD207+ CD80+ HLA-DR– CD207+ CD80+ HLA-DR+ |
57 0,9 7,0 0,5 |
|
Эндотелиальные клетки, из них активированные |
CD146+ CD146+ CD54– HLA-DR+ CD146+ CD54+ HLA-DR– CD146+ CD54+ HLA-DR+ CD146+ CD34+ |
0,9 4,2 12,5 0 0,2 |
|
Тучные клетки, из них активированные |
CD249+ CD249+ CD63+ |
2,6 1,9 |
|
Моноциты, из них активированные |
CD45+ CD14+ CD45+ CD14+ HLA-DR+ |
4,0 2,5 |
|
Эпидермальные лимфоциты: Т-общие Т-хелперы Т-цитотоксические В-лимфоциты NK-клетки |
CD45+ CD3+ CD45+ CD3+ CD4+ CD8– CD45+ CD3+ CD4– CD8+ CD45+ CD3+ CD19+ CD45+ CD3– CD16+ CD56+ |
15 11 2 5 14 |
|
Жизнеспособность, % |
92 |
Жизнеспособность клеток – 92 %, что указывает на хорошее качество пробы и отсутствие выраженного некроза. Фенотипический профиль отражает иммунно-воспалительный тип кожного ответа с активным участием антигенпрезентирующих клеток, лимфоцитарного звена и умеренным сосудистым компонентом. В отличие от пузырчатки, воспаление здесь клеточно-опосредованное, без массивного эпидермолиза, но с выраженным цитотоксическим и хелперным потенциалом.
Анализ субпопуляций клеток представлен ниже.
Кератиноциты (CD49f+ HLA-DR+). Общая доля – 41 %, активированные – 29,7 %. Отмечается повышенная экспрессия HLA-DR, свидетельствующая о превращении кератиноцитов в «квазиантигенпрезентирующие» клетки. Это один из ключевых механизмов патогенеза красного плоского лишая: кератиноциты становятся мишенью для CD8+ Т-клеток, но одновременно участвуют в поддержании воспаления. Высокая доля активированных клеток подтверждает наличие активного цитотоксического процесса в эпидермисе.
Фибробласты (CD45– CD14– CD44+ / CD80+). Общее содержание – 54 %, активированные – 0,6 %. Это указывает на сохраненный, но неактивный дермальный матрикс. Фибробласты не вовлекаются в острую фазу воспаления, однако обеспечивают структурную поддержку и участвуют в ремоделировании базальной мембраны, которая при красном плоском лишае страдает в первую очередь.
Клетки Лангерганса (CD207+ CD80+ HLA-DR+). Общее количество – 57 %, при этом активированные формы (CD80+ HLA-DR+) – 0,9 %, HLA-DR– составляет 7 %, DR+ – 0,5 %. Снижение уровня DR+ клеток указывает на умеренную антиген-презентацию при хроническом течении. Наблюдается персистирующая стимуляция иммунного надзора, что объясняет устойчивость высыпаний и склонность к рецидивам.
Эндотелиальные клетки (CD146+ / CD54+ / CD34+). Совокупная доля – около 18 %, преобладает CD54+ HLA-DR– (12,5 %). Это признак умеренной эндотелиальной активации, сопровождающейся локальной вазодилатацией и инфильтрацией лимфоцитов в дермо-эпидермальную зону. Присутствие CD34+ (0,2 %) – маркер слабовыраженного ангиогенеза.
Тучные клетки (CD249+ / CD63+). Общее количество – 2,6 %, активированные – 1,9 %. Наблюдается умеренная дегрануляция тучных клеток, участвующих в усилении зуда и поддержании локальной воспалительной реакции.
Моноциты (CD45+ CD14+ / HLA-DR+). Общее содержание – 4 %, активированные – 2,5 %. Это соответствует умеренной макрофагальной инфильтрации, участвующей в разрушении поврежденных кератиноцитов и очистке зоны базальной мембраны.
Эпидермальные лимфоциты:
Наблюдается Th-доминантный профиль при низком уровне CD8+ клеток, что согласуется с хроническим типом воспаления, когда цитотоксическое звено уже отработало, а в тканях сохраняются эффекторные и память-Т-клетки. Повышение уровня NK-клеток (14 %) указывает на вовлечение врожденного иммунного надзора и коррелирует с устойчивостью очагов.
Фенотип соответствует хроническому клеточно-опосредованному воспалению с умеренным цитотоксическим компонентом, высокой активацией кератиноцитов и умеренным вовлечением эндотелия. Эпидермис остается гиперактивным и иммунокомпетентным, но процессы регенерации дермы подавлены. Суммарно профиль можно отнести к Th1/Th17-доминантному типу воспаления – типичному для красного плоского лишая.
Цитоиммунограмма кожи пациентки Л. демонстрирует следующее:
Таким образом, фенотип соответствует хроническому Th1/Th17-опосредованному воспалению с клеточной инфильтрацией в дермо-эпидермальной зоне, характерному для красного плоского лишая. Данные ЦИГК подтверждают необходимость иммуномодулирующей и анти-Th-терапии для восстановления структурно-клеточного равновесия кожи.
В примере показана возможность получения дополнительных сведений о состоянии клеток наблюдаемого воспалительного инфильтрата как до лечения, так и после.
Так, только по одному показателю цитоиммунограммы кожи можно проследить, что количество активированных кератиноцитов в биоптате из инфильтрата до лечения пациентки составляло 29,7 %, а после традиционного лечения – 8,9 % (рис. 54).
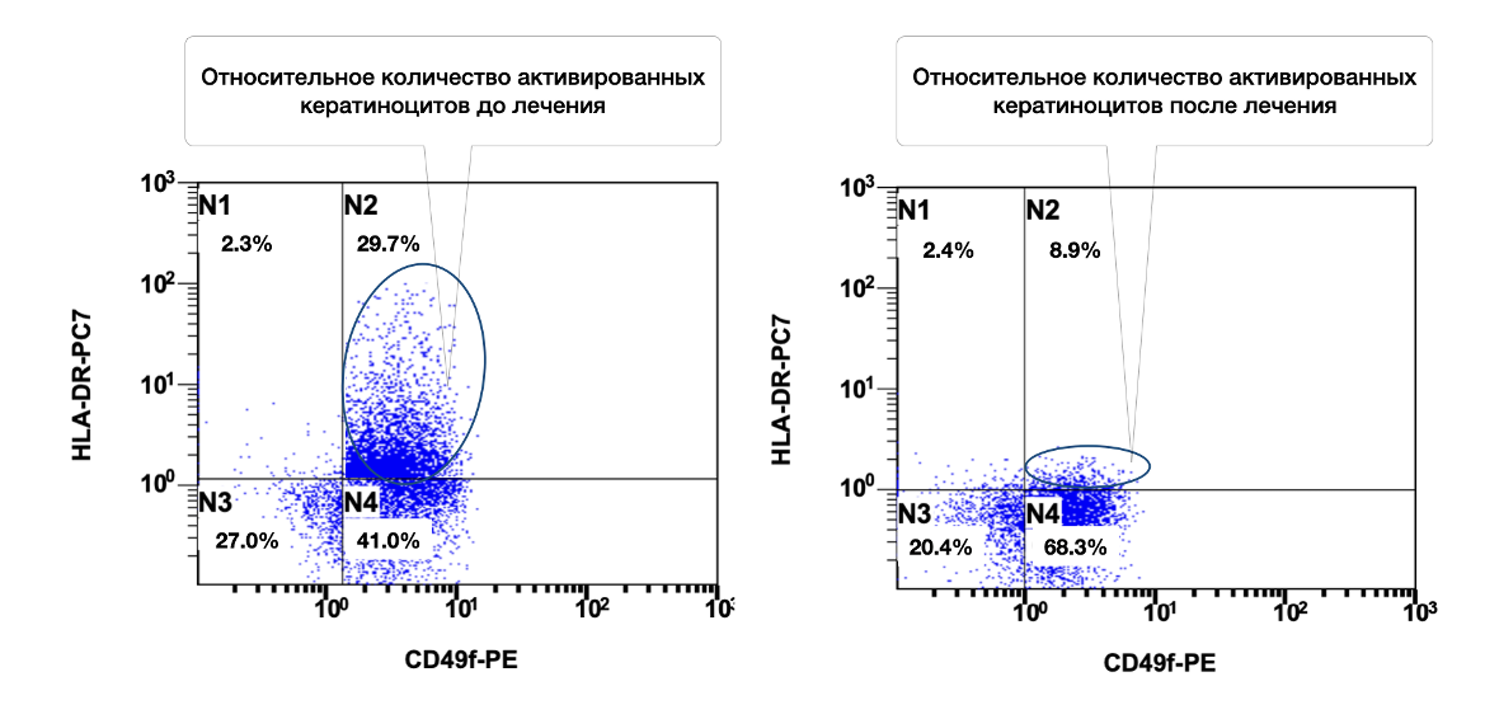
Рисунок 54. Сравнительная характеристика относительного количества жизнеспособных активированных кератиноцитов (фенотип CD49f+ HLA-DR+) в суспензии клеток биоптата кожи пациентки Л., 52 года, от 12 ноября 2016 г. № 138/4 и 27 ноября 2016 г. № 138/5
На цитоиммунограмме представлены результаты анализа жизнеспособных активированных кератиноцитов (фенотип CD49f+ HLA-DR+) в клеточной суспензии биоптата кожи пациентки с красным плоским лишаем до и после проведенного лечения.
Распределение клеточных популяций:
|
Квадрант |
Фенотип клеток |
До лечения (%) |
После лечения (%) |
|---|---|---|---|
|
N2 |
CD49f⁺ HLA-DR⁺ – активированные жизнеспособные кератиноциты |
29.7% |
8.9% |
|
N4 |
CD49f⁺ HLA-DR⁻ – жизнеспособные неактивированные кератиноциты |
41.0% |
68.3% |
|
N1 |
CD49f⁻ HLA-DR⁺ |
2.3% |
2.4% |
|
N3 |
CD49f⁻ HLA-DR⁻ |
27.0% |
20.4% |
Интерпретация результатов:
До лечения наблюдается значительное количество активированных кератиноцитов (29.7%), что типично для воспалительных дерматозов, сопровождающихся гиперактивацией эпидермального звена и антиген-презентирующей функцией кератиноцитов.
После курса терапии доля этих активированных кератиноцитов существенно снизилась до 8.9%, что говорит о снижающейся эпидермальной активации, купировании воспалительного процесса и нормализации функционального статуса эпидермиса.
Параллельно увеличилось количество жизнеспособных неактивированных кератиноцитов (N4) с 41.0% до 68.3%, что свидетельствует о восстановлении структуры и функции эпидермального барьера, сохранении клеточной жизнеспособности и регенераторного потенциала кожи.
Таким образом, у пациентки в динамике терапии наблюдается:
выраженное снижение количества активированных кератиноцитов (CD49f⁺ HLA-DR⁺);
рост доли жизнеспособных неактивированных кератиноцитов, что отражает положительную клинико-иммунологическую динамику.
Это свидетельствует об эффективности проводимого лечения, направленного на снижение воспаления, восстановление эпидермальной архитектоники и купирование иммунного ответа на уровне кожи.
В данном случае способ получения цитоиммунограмм кожи позволил дерматологу собрать дополнительную объективную информацию о наличии аутоиммунного пролиферативного процесса в инфильтрате кожи пациента и учитывать эти результаты в проводимом лечении.
Согласно тем же вышеуказанным рекомендациям, «псориаз – системное иммуноассоциированное заболевание мультифакториальной природы с доминирующим значением в развитии генетических факторов, характеризующееся ускоренной пролиферацией эпидермоцитов и нарушением их дифференцировки, иммунными реакциями в дерме и синовиальных оболочках, дисбалансом между провоспалительными и противовоспалительными цитокинами, хемокинами; частыми патологическими изменениями опорно-двигательного аппарата». Для состояния иммунитета больного и его кожи «безусловное значение имеют наследственная предрасположенность, нарушения функции иммунной, эндокринной, нервной систем, неблагоприятное воздействие факторов внешней среды и нередкое сочетание с системными заболеваниями, включая метаболический синдром, сахарный диабет II типа, ишемическую болезнь сердца, артериальную гипертензию, патологию гепатобилиарной системы и др.». Один из таких пациентов демонстрирует следующие показатели цитоиммунограммы кожи (табл. 6).
Таблица 6. Цитоиммунограмма кожи пациента Б., 51 год, от 2 июня 2018 г. № 89/2
|
Субпопуляции клеток кожи и жизнеспособность |
Фенотип |
Показатели, % |
|
Кератиноциты, из них активированные |
CD49f+ CD49f+ HLA-DR+ |
65 54,4 |
|
Фибробласты, из них активированные |
CD45– CD14– CD44+ CD45– CD14– CD44+ CD80+ |
20 2,9 |
|
Клетки Лангерганса, из них активированные |
CD207+ CD207+ CD80– HLA-DR+ CD207+ CD80+ HLA-DR– CD207+ CD80+ HLA-DR+ |
58,3 23,9 14,4 9,8 |
|
Эндотелиальные клетки, из них активированные |
CD146+ CD146+ CD54– HLA-DR+ CD146+ CD54+ HLA-DR– CD146+ CD54+ HLA-DR+ CD146+ CD34+ |
1,4 0 19,9 0,4 1,9 |
|
Тучные клетки, из них активированные |
CD249+ CD249+ CD63+ |
1,6 0,3 |
|
Моноциты, из них активированные |
CD45+ CD14+ CD45+ CD14+ HLA-DR+ |
6,6 0,1 |
|
Эпидермальные лимфоциты: Т-общие Т-хелперы Т-цитотоксические В-лимфоциты NK-клетки |
CD45+ CD3+ CD45+ CD3+ CD4+ CD8– CD45+ CD3+ CD4– CD8+ CD45+ CD3+ CD19+ CD45+ CD3– CD16+ CD56+ |
15 10 5 7 8 |
|
Жизнеспособность, % |
89 |
Клеточная жизнеспособность – 89 %, что свидетельствует о хорошем качестве биоптата и отсутствии массивного некроза. Иммунно-клеточный профиль кожи демонстрирует высокоактивный пролиферативно-воспалительный фенотип, характерный для псориатического процесса:
Этот фенотип соответствует стабилизированному, но активному типу псориатического воспаления.
Анализ субпопуляций клеток дан ниже.
Кератиноциты (CD49f+ HLA-DR+). Общая доля – 65 %, активированные (HLA-DR+) – 54,4 %, что значительно превышает норму. Такая гиперактивация отражает ускоренный клеточный цикл и патологическую пролиферацию эпидермиса, типичные для псориаза. Экспрессия HLA-DR на кератиноцитах свидетельствует о вовлечении их в иммунную презентацию антигенов, что поддерживает хроническое воспаление по механизму «самоподдерживающегося цитокинового цикла» (IL-23/Th17-ось).
Фибробласты (CD45– CD14– CD44+ / CD80+). Общее количество – 20 %, активированные формы – 2,9 %. Отмечается умеренная активность дермальных фибробластов, участвующих в ремоделировании матрикса и поддержании воспалительной микросреды. Пониженная доля активированных клеток указывает на дисбаланс между воспалением и репарацией, что характерно для псориатического гиперпролиферативного очага.
Клетки Лангерганса (CD207+ CD80+ HLA-DR+). Общая доля – 58,3 %, активированные формы (CD80+ HLA-DR+/–) суммарно превышают 48 %. Это выраженный показатель гиперактивности антигенпрезентирующего звена, что согласуется с центральной ролью клеток Лангерганса и дендритных клеток в патогенезе псориаза (инициация Th17-ответа и выработка IL-23). Фенотип показывает устойчивое воспаление с активной антигенной стимуляцией.
Эндотелиальные клетки (CD146+ CD54+ CD34+). Совокупная доля – ≈ 23 %, при этом доля CD54+ HLA-DR– составляет 19,9 %. Отмечается ярко выраженная эндотелиальная активация, отражающая ангиогенез и формирование патологической микрососудистой сети, характерной для псориатических бляшек. Присутствие CD34+ (1,9 %) – признак активного ангиогенеза. Эндотелиальный компонент является одним из ключевых морфологических признаков псориаза.
Тучные клетки (CD249+ CD63+). Общее количество – 1,6 %, активированные – 0,3 %. Активность мастоцитов низкая, что типично для хронической фазы, где медиаторы воспаления поддерживаются лимфоцитами и кератиноцитами, а не дегрануляцией тучных клеток.
Моноциты (CD45+ CD14+ HLA-DR+). Доля – 6,6 %, активированные – 0,1 %. Это отражает низкое участие фагоцитарного звена, характерное для не экссудативного воспаления. Макрофаги находятся в состоянии относительного покоя, что согласуется с хроническим характером процесса.
Эпидермальные лимфоциты:
Иммунный профиль Th-доминантный, с акцентом на Th17/Th1-ответ и умеренным цитотоксическим звеном (CD8+). Наличие B- и NK-клеток подтверждает вовлечение смешанного адаптивно-врожденного иммунного каскада.
Фенотип соответствует хроническому Th17-опосредованному воспалению с выраженной эпидермальной гиперактивацией и ангиогенным компонентом. Основные черты:
Такой тип ЦИГК отражает стойкий воспалительно-пролиферативный фенотип кожи, поддерживаемый петлей цитокинов IL-23 → IL-17 → IL-22.
Цитоиммунограмма кожи пациента Б. демонстрирует:
Фенотип соответствует активной стадии псориаза с выраженной гиперпролиферацией и цитокин-зависимым воспалением. В рамках фенотипической дерматологии данный профиль можно охарактеризовать как воспалительно-пролиферативный тип с ангиогенной доминантой, что определяет следующие направления терапии:
Привычно считать, что «диагноз "псориаз" устанавливают на основании клинической картины заболевания, выявления симптомов псориатической триады, наличия феномена Кебнера», а «появлением на коже папулезных элементов розово-красного цвета с четкими границами, склонных к слиянию и образованию бляшек различных очертаний и величины, покрытых серебристо-белыми чешуйками, преимущественно на волосистой части головы, разгибательной поверхности локтевых, коленных суставов, в области поясницы, крестца с зудом различной степени интенсивности» обеспокоен только данный пациент (рис. 55).
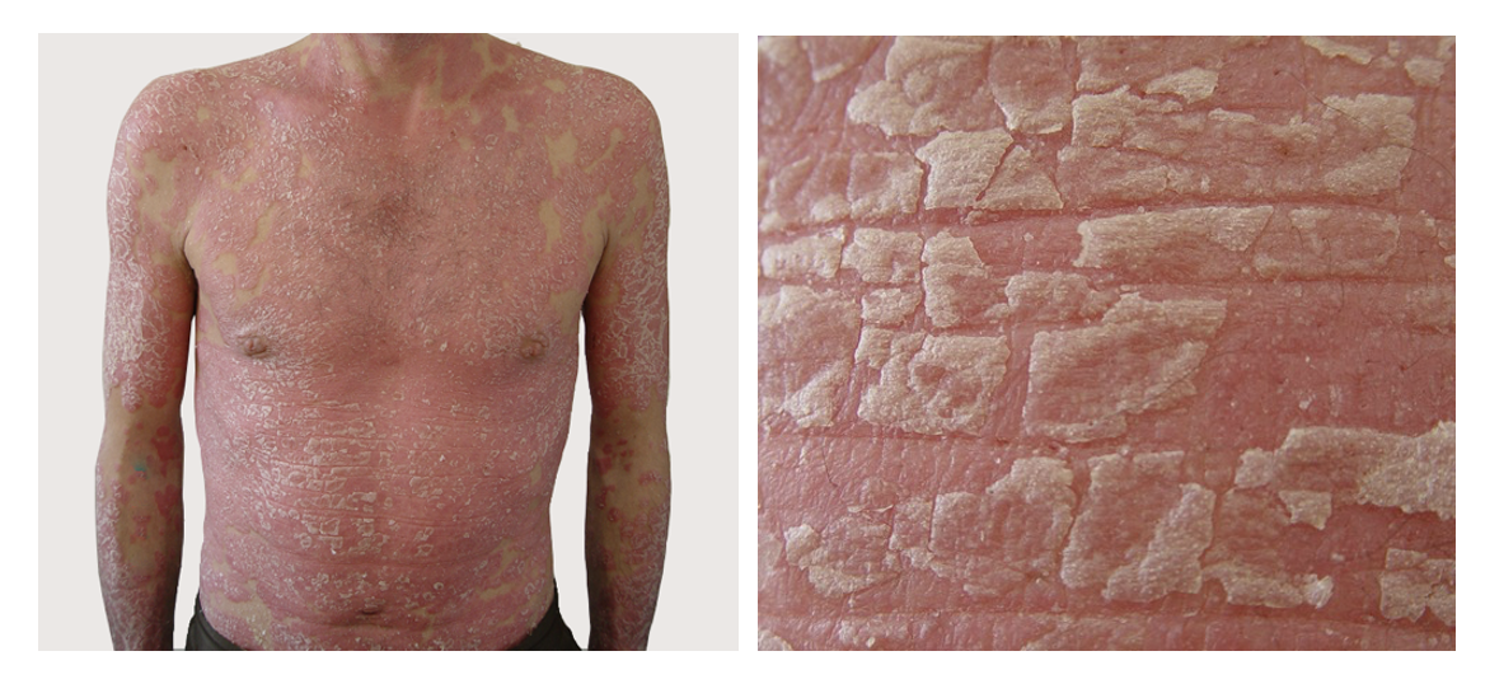
Рисунок 55. Клиническая демонстрация локального статуса пациента Б., 51 год, от 2 июня 2018 г. № 89/2
На наш взгляд, лечащему доктору требуется оценить состав клеток в биоптате кожи для того, чтобы зафиксировать картину на уровне клеток до лечения. Как выражены функции клеток каждого вида, что создали такую клиническую картину? А как они выражены после лечения (рис. 56)?.
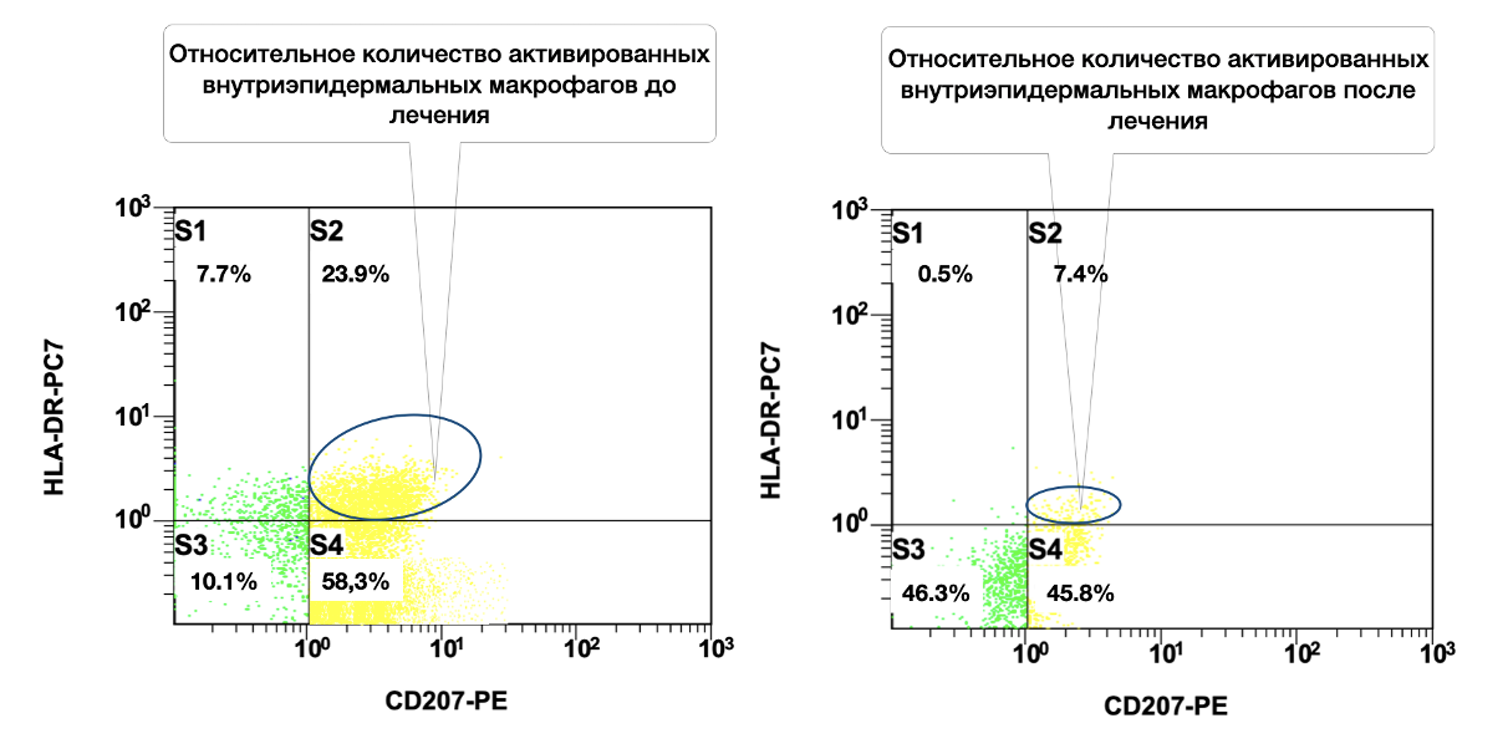
Рисунок 56. Сравнительная характеристика относительного количества жизнеспособных активированных внутриэпидермальных макрофагов (фенотип CD207+ HLA-DR+) в суспензии клеток биоптата кожи пациента Б., 51 год, от 2 июня 2018 г. № 89/2 и 17 июня 2018 г. № 89/3
На цитоиммунограмме показана динамика изменения относительного количества жизнеспособных активированных внутриэпидермальных макрофагов (фенотип CD207⁺ HLA-DR⁺) в клеточной суспензии биоптата кожи пациента с псориазом, до и после лечения.
Распределение клеточных популяций:
|
Квадрант |
Фенотип клеток |
До лечения (%) |
После лечения (%) |
|---|---|---|---|
|
S2 |
CD207⁺ HLA-DR⁺ – активированные макрофаги |
23.9% |
7.4% |
|
S4 |
CD207⁺ HLA-DR⁻ – неактивированные макрофаги |
58.3% |
45.8% |
|
S1 |
HLA-DR⁺ CD207⁻ |
7.7% |
0.5% |
|
S3 |
HLA-DR⁻ CD207⁻ |
10.1% |
46.3% |
Интерпретация результатов:
До лечения:
Доля активированных внутриэпидермальных макрофагов (CD207⁺ HLA-DR⁺) составляет 23.9%, что отражает выраженную локальную иммунную активацию и участие клеток Лангерганса в патогенезе псориаза.
Высокая доля таких клеток соответствует иммунопатологической активности, типичной для псориатического воспаления.
После лечения:
Относительное количество активированных макрофагов снижается почти в 3 раза — до 7.4%, что говорит о снижении локального иммунного ответа, купировании воспаления и восстановлении кожного гомеостаза.
Одновременно наблюдается рост доли неактивированных (HLA-DR⁻) CD207⁺ клеток, а также выраженное увеличение популяции S3 (CD207⁻ HLA-DR⁻), что может отражать возврат к физиологическому состоянию иммунной среды эпидермиса.
В итоге, у данного пациента наблюдается:
существенное снижение активации внутриэпидермальных макрофагов CD207⁺ HLA-DR⁺, что демонстрирует эффективность терапии;
восстановление клеточного состава эпидермиса за счёт увеличения жизнеспособных, но неактивированных иммунных клеток;
иммунологический ответ переходит из состояния хронического воспаления в ремиссию.
Эти данные свидетельствуют о позитивной динамике лечения, с купированием патологического иммунного воспаления, характерного для псориаза. Но, при сопоставлении выявленного фенотипа с применением лекарственных препаратов, направленно действующих на обнаруженные показатели, лечение больного приобретет предметно-направленный характер. Если же таковые препараты еще не разработаны, то цитоиммунограмма кожи данного пациента может быть использована для объективной оценки эффективности проведенного лечения, а также с целью фиксации сведений о состоянии его кожи в динамике хронического заболевания.
Хроническая стадия экземы характеризуется инфильтрацией и усилением кожного рисунка пораженного участка, поствоспалительной гипо- и гиперпигментацией. Постоянными признаками экземы являются зуд, усиливающийся при обострении заболевания, жжение, болезненность в очагах поражения (рис. 57). Описанные симптомы характеризуют довольно обширную часть заболеваний кожи. А ведь речь идет о заболевании, в общей структуре патологии кожи составляющем до 40 %. Как и при большинстве заболеваний кожи, гистологическое исследование биоптатов кожи проводится с целью дифференциальной диагностики. Но не для подбора лечения, что странно.
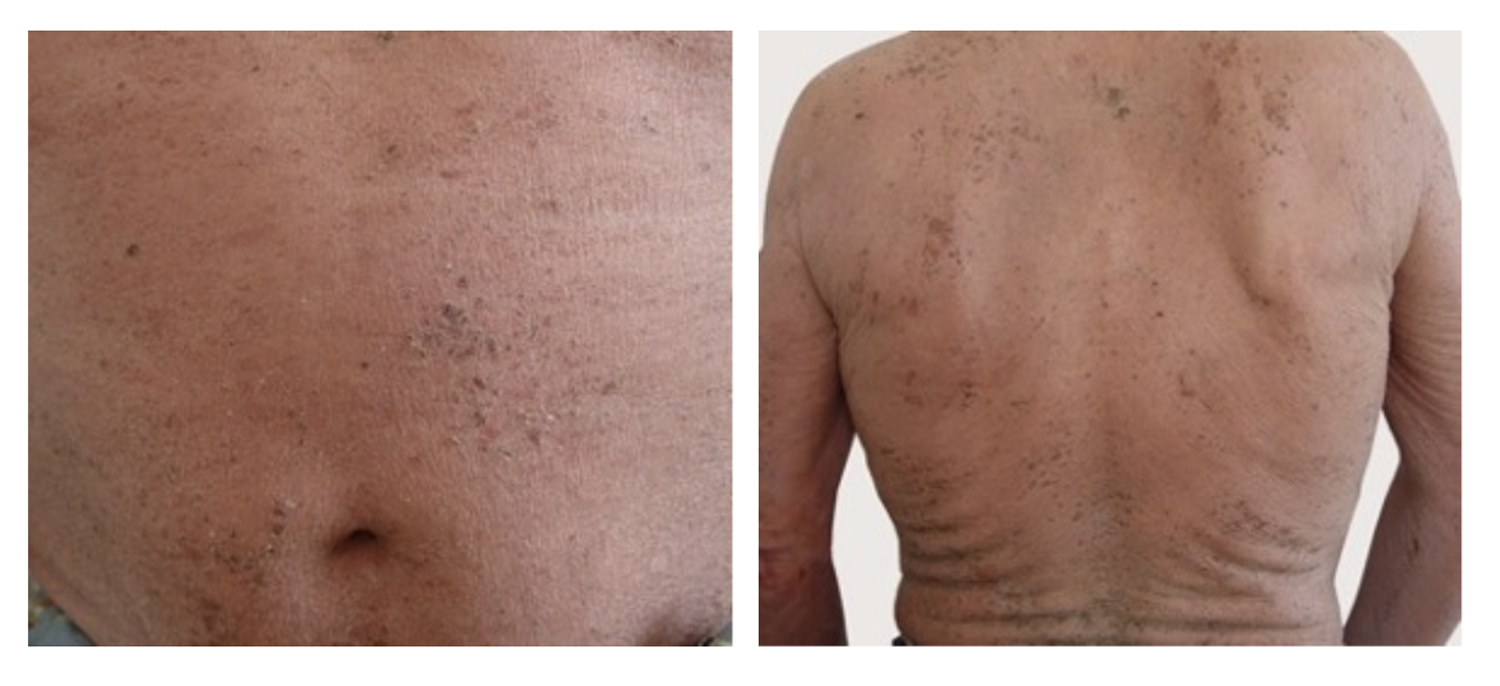
Рисунок 57. Клиническая демонстрация локального статуса пациента Л., 48 лет, от 3 ноября 2014 г. № 39/2
При остром процессе наблюдается спонгиоз, большое количество мелких пузырьков в эпидермисе; внутриклеточный отек в клетках шиповатого слоя; в дерме – расширение сосудов поверхностной сосудистой сети, отек сосочков и лимфоидно-клеточная инфильтрация вокруг сосудов. При хроническом процессе в дерме отмечается периваскулярный инфильтрат, состоящий из лимфоцитов, фибробластов, гистиоцитов, эозинофилов; в эпидермисе – акантоз, гиперкератоз, паракератоз, незначительный отек.
Цитоиммунограмма кожи позволяет добавить к данному описанию еще и функциональную характеристику клеток кожи (табл. 7), особенно необходимую для оценки состояния кожи, как активно функционирующей ткани, в возрастной группе пациентов, на долю которых приходится более половины среди всех заболевающих (рис. 58).
Таблица 7. Цитоиммунограмма кожи пациента Л., 48 лет, от 3 ноября 2014 г. № 39/2
|
Субпопуляции клеток кожи и жизнеспособность |
Фенотип |
Показатели, % |
|
Кератиноциты, из них активированные |
CD49f+ CD49f+ HLA-DR+ |
66 3,5 |
|
Фибробласты, из них активированные |
CD45– CD14– CD44+ CD45– CD14– CD44+ CD80+ |
69 4,2 |
|
Клетки Лангерганса, из них активированные |
CD207+ CD207+ CD80– HLA-DR+ CD207+ CD80+ HLA-DR– CD207+ CD80+ HLA-DR+ |
45 1,0 5,0 0,3 |
|
Эндотелиальные клетки, из них активированные |
CD146+ CD146+ CD54– HLA-DR+ CD146+ CD54+ HLA-DR– CD146+ CD54+ HLA-DR+ CD146+ CD34+ |
1,0 0,1 19,7 1,7 1,5 |
|
Тучные клетки, из них активированные |
CD249+ CD249+ CD63+ |
75,4 8,9 |
|
Моноциты, из них активированные |
CD45+ CD14+ CD45+ CD14+ HLA-DR+ |
4,5 1,7 |
|
Эпидермальные лимфоциты: Т-общие Т-хелперы Т-цитотоксические В-лимфоциты NK-клетки |
CD45+ CD3+ CD45+ CD3+ CD4+ CD8– CD45+ CD3+ CD4– CD8+ CD45+ CD3+ CD19+ CD45+ CD3– CD16+ CD56+ |
13 11 2 4 7 |
|
Жизнеспособность, % |
89 |
Жизнеспособность клеток – 89 %, что указывает на качественную пробу с сохранением клеточного гомеостаза. Фенотип кожи демонстрирует воспалительно-регенераторный тип – сочетание умеренной иммунной активности с признаками репарации и стабилизации тканевого микроокружения. Клеточный профиль отражает типичную для хронической экземы смешанную Th2/Th1-ответную реакцию с умеренной дегрануляцией тучных клеток, активацией кератиноцитов и фибробластов, а также вовлечением эндотелиальных элементов.
Ниже – анализ субпопуляций клеток.
Кератиноциты (CD49f+ HLA-DR+). Общая доля – 66 %, активированные формы – 3,5 %. Наблюдается умеренная активация эпидермиса, отражающая баланс между воспалительной стимуляцией и процессами восстановления. Отсутствует выраженная HLA-DR-гиперэкспрессия, что отличает этот фенотип от атопического дерматита и псориаза. Эпидермис функционально активен, но не гиперреактивен – состояние соответствует фазе ремиссии.
Фибробласты (CD45– CD14– CD44+ / CD80+). Общее количество – 69 %, активированные формы – 4,2 %. Отмечается повышенная активность дермальных фибробластов, указывающая на процессы ремоделирования и репарации внеклеточного матрикса. Такой профиль типичен для хронической экземы, где воспаление сочетается с постоянной попыткой восстановления барьерных структур кожи.
Клетки Лангерганса (CD207+). Общее количество – 45 %, активированные фенотипы (CD80+ HLA-DR+/–) – около 6 %. Уровень антигенпрезентирующей активности умеренный. Этот показатель отражает снижение интенсивности иммунного надзора по сравнению с острой фазой при сохранении базового уровня антигенного распознавания. Фенотип типичен для персистирующего субклинического воспаления.
Эндотелиальные клетки (CD146+ CD54+ CD34+). Совокупная доля – около 23 %, с преобладанием CD54+ HLA-DR– (≈ 19,7 %). Это признак умеренной эндотелиальной активации и поддержания сосудистого компонента воспаления. Наличие CD34+ (1,5 %) свидетельствует о сохранении ангиогенетического потенциала и микроциркуляторной адаптации.
Тучные клетки (CD249+ CD63+). Общая доля – 75,4 %, активированные – 8,9 % (высокая дегрануляция). Это важный фенотипический маркер экзематозных процессов – мастоцитарная активация инициирует зуд, эритему и сосудистую реактивность. Активность мастоцитов остается ключевым фактором хронизации.
Моноциты (CD45+ CD14+ HLA-DR+). Доля – 4,5 %, активированные – 1,7 %. Фагоцитарное звено умеренно активно, что отражает баланс между очищением и поддержанием воспаления. Снижение активности по сравнению с острыми формами – признак стабилизации процесса.
Эпидермальные лимфоциты:
Иммунный профиль имеет Th2-доминантность с умеренным цитотоксическим компонентом. Такое распределение характерно для хронических экзематозных состояний, где преобладают IL-4/IL-13-зависимые механизмы воспаления и сохранен контроль врожденного звена через NK-клетки.
Фенотип кожи пациента Л. указывает на умеренно активное хроническое воспаление с выраженными признаками регенераторной компенсации. Основные черты:
Этот тип ЦИГК соответствует «воспалительно-репаративному фенотипу», типичному для хронических форм экземы. Цитоиммунограмма кожи пациента Л. отражает стабильное хроническое воспаление с признаками восстановления:
Таким образом, кожа находится в фенотипическом состоянии «ремиссионного воспаления» – баланс между воспалением и восстановлением. Этот фенотип благоприятен для целенаправленной регенераторной терапии, включая препараты, усиливающие трофику и нормализующие микроокружение кожи.
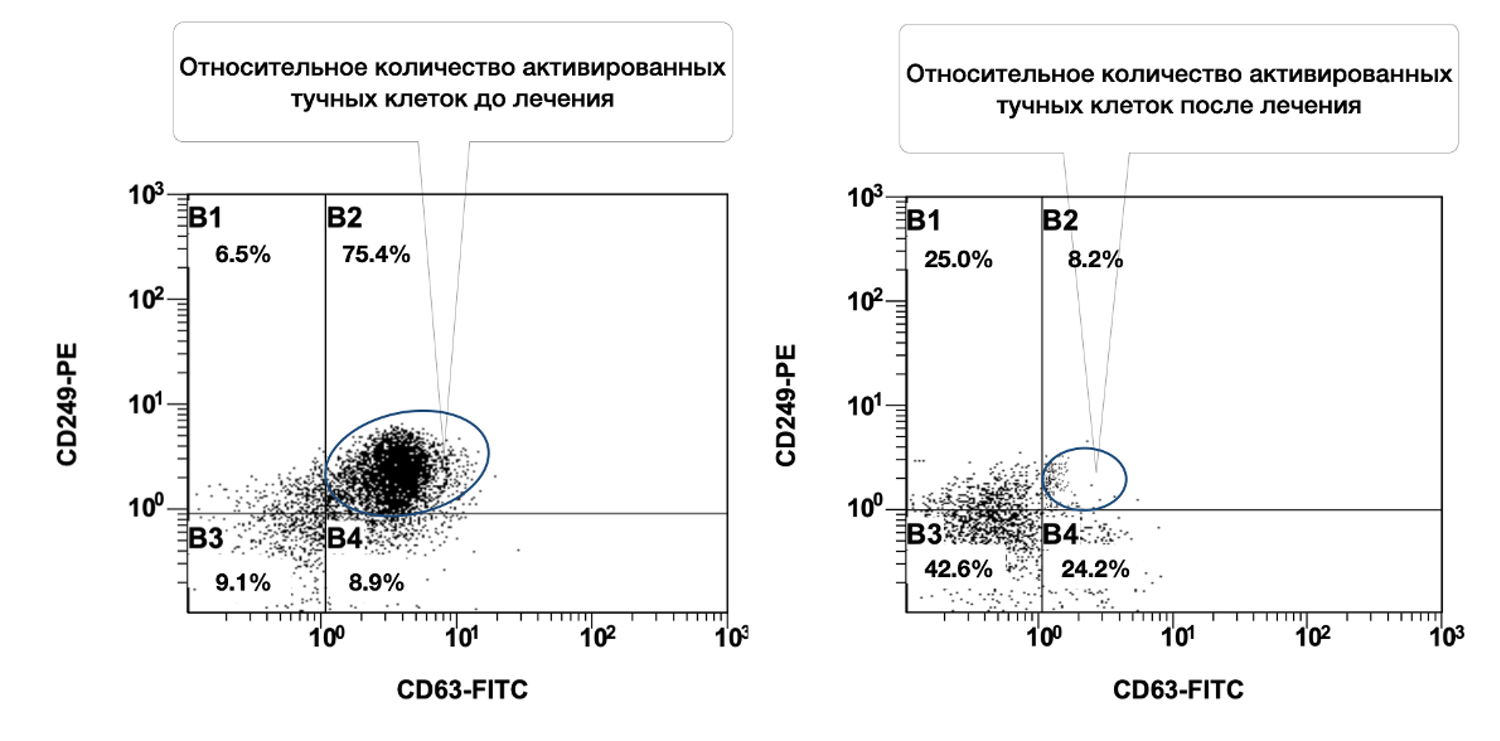
Рисунок 58. Сравнительная характеристика относительного количества жизнеспособных активированных тучных клеток (фенотип CD249+ CD63+) в суспензии клеток биоптата кожи пациента Л., 48 лет, от 3 ноября 2014 г. № 39/2 и от 18 ноября 2014 г. № 39/3
На представленной паре цитоиммунограмм методом проточной цитометрии выполнен анализ относительного количества жизнеспособных активированных тучных клеток (фенотип CD249⁺ CD63⁺) в клеточной суспензии биоптатов кожи пациента с хронической экземой — до и после лечения.
Распределение клеточных популяций:
|
Квадрант |
Фенотип клеток |
До лечения (%) |
После лечения (%) |
|---|---|---|---|
|
B2 |
CD249⁺ CD63⁺ – активированные тучные клетки |
75.4% |
8.2% |
|
B4 |
CD249⁺ CD63⁻ – неактивированные тучные клетки |
8.9% |
24.2% |
|
B1 |
CD249⁻ CD63⁺ |
6.5% |
25.0% |
|
B3 |
CD249⁻ CD63⁻ |
9.1% |
42.6% |
Интерпретация результатов:
До лечения:
Наблюдается чрезвычайно высокая доля активированных тучных клеток: 75.4%, что отражает выраженный аллергический и воспалительный фон, характерный для хронической экземы.
Количество неактивированных тучных клеток (CD249⁺ CD63⁻) — всего 8.9%, что указывает на повсеместную активацию тучных клеток в коже.
После лечения:
Доля активированных тучных клеток резко снижается почти в 10 раз — с 75.4% до 8.2%, что свидетельствует об эффективной супрессии воспаления.
Увеличивается популяция неактивированных жизнеспособных тучных клеток (CD249⁺ CD63⁻) — до 24.2%, а также CD249⁻ CD63⁻ клеток (B3) — до 42.6%, что может указывать на восстановление кожного иммунного баланса и возможную репопуляцию клеточного пула.
В заключении можно сказать, что у данного пациента с хронической экземой:
Изначально отмечалась гиперактивация тучных клеток (основных медиаторов аллергических и воспалительных реакций кожи).
После терапии наступает выраженное снижение активации тучных клеток, что соответствует клинической ремиссии и купированию воспалительного каскада.
Восстановление доли неактивированных жизнеспособных клеток указывает на сохранность резерва ткани и потенциал к нормальному иммунному ответу.
Диаграммы убедительно демонстрируют иммуномодулирующее действие терапии и её высокую эффективность при лечении хронической экземы.
Представленными примерами демонстрируется эффективность получения цитоиммунограмм кожи для оценки состояния кожи перед началом лечения, по достижении клинической ремиссии и в качестве критериев результативности проводимой терапии. Прецизионная (более точная, поскольку выражена в цифрах) диагностика уже сейчас закладывает основания для будущих практических реализаций.
Но поводов к разработкам с заданными параметрами фенотипа клеток гораздо больше.
Любое повреждение кожи запускает сложный каскад организованных во времени и пространстве событий, обеспечивающих восстановление гомеостаза и закрытие раневой поверхности60. Этот процесс включает несколько фаз: воспаление, пролиферация (образование грануляций и эпителизация) и ремоделирование61, каждая из которых реализует определенные процессы как на клеточном, так и на молекулярном уровне62. На каждом этапе эти процессы регулируются растворимыми факторами63, за которыми закреплены конкретные механизмы регуляции, открывающие возможности влияния на репаративный процесс. Это стало поводом к разработке биотехнологического средства с заявленным эффектом действия – ранозаживление.
Клетки кожи, занимая то или иное положение в архитектонике, имеют значение в контексте выполняемых ими функций. Так, эпителиальные стволовые клетки, расположенные в области ложа волосяного фолликула, являются предшественниками развития клеточных популяций, обеспечивающих формирование эпителиальных структур кожи – интерфолликулярного эпидермиса, волосяных фолликулов, сальных и потовых желез64, а также всех клеточных линий65. При повреждении кожи они служат источником восстановления интерфолликулярного эпителия и оказывают локальное противовоспалительное действие, устраняя дисбаланс про- и противовоспалительных цитокинов в поврежденной ткани66.
Учитывая, что образование грануляционной ткани сопровождается освобождением широкого спектра факторов роста и цитокинов, стимулирующих пролиферацию кератиноцитов, реэпителизация раны, казалось бы, не является проблемой. Однако в реальности при глубоких повреждениях кожи погибает не только эпидермис, но и эпителиальные производные кожи – волосяные фолликулы и железы. Это ведет к нарушению механизмов реэпителизации и гистоархитектоники дермы, утратившей структурообразующие микромодули волосяного фолликула и желез67, а полноценное восстановление эпидермиса и эпителиальных структур кожи возможно лишь при условии сохранения пула эпителиальных стволовых клеток.
Изучение механизма действия эпителиальных стволовых клеток было существенно расширено после открытия в составе CD34+ гемопоэтических клеток мононуклеарной фракции костного мозга относительно небольшой популяции эндотелиальных клеток-предшественников68. При структурной перестройке сосудистой сети в поврежденной ткани, в основе которой лежит развитие коллатеральных артериол и ветвление капилляров, формирование микрососудов de novo протекает с участием именно эндотелиальных клеток-предшественников, мигрирующих из костного мозга в периферический кровоток и далее в зоны ишемии69,70.
Показано, что в ответ на ишемию увеличивается их число и имеются доказательства возможности встраивания этих клеток в стенку капилляра с последующей дифференцировкой в зрелые эндотелиоциты. Если бы не способность эндотелиальных клеток восстанавливать сеть кровеносных сосудов и осуществлять рост тканей, то репарация кожи была бы невозможна71. Уже одно это обстоятельство выделяет эндотелиальные клетки как основные в регуляции репаративного процесса, поскольку известно, что их количество и функциональность определяют исход репарации. Кроме того, эндотелиальные клетки-предшественники, как и другие CD34+ гемопоэтические клетки, способны активировать резидентные эндотелиальные клетки действием ангиогенных факторов72.
Утрата пула эпителиальных стволовых и эндотелиальных клеток-предшественников определяет нарастающий дефицит репаративного потенциала, который неизбежно проявится в следующей фазе процесса заживления ран – ремоделировании. Последняя подразумевает под собой процесс перестройки грануляционной ткани. И если клеточный и молекулярный дефицит репаративного потенциала своевременно не компенсируется, то произойдет замещение грануляционной ткани зрелой соединительной тканью, которое протекает с формированием рубца.
С целью компенсации дефицита репаративного потенциала и стимуляции заживления обширных ран кожи внедрение в практическую медицину клеточных технологий привело не только к широкому использованию мезенхимальных стромальных стволовых клеток, получаемых из красного костного мозга или аутофибробластов, выделяемых из дермы, но и сопроводилось утверждением концепции «стволовой ниши»73.
Понятие «ниша» предполагает сочетание клеточного микроокружения и внеклеточного матрикса, специфичное для стволовых клеток, которое может служить местом их трансформации. В нише продуцируются химические факторы, регулирующие пролиферацию, селекцию и дифференцировку клеток. По современным представлениям «стволовая ниша» представляет особую микросферу, которая включает элементы самой клетки и окружающего матрикса, то есть ее клеточной «архитектуры». Именно окружающая среда обеспечивает сохранение трансформирующихся клеток и регулирует этапы их дифференцировки: первая группа – клетки, которые уже в начальной стадии подвергаются постмитотической гибели посредством апоптоза; значение второй группы клеток, не подверженных апоптозу и дифференцировке, в формировании самой ниши; третью группу составляют молодые клетки, которые, созревая, становятся зрелыми74.
Ниша для эпителиальных стволовых клеток эпидермиса имеет конечные размеры. Каждая состоит из группы клеток, содержащих/ей пролиферирующие и дифференцирующиеся клетки. В центре каждой обособленной группы базальных клеток находится одна, которая может быть отнесена к категории стволовых. Она асимметрично делится и дает (после 4-кратного деления) клон из 9–11 базальных клеток. Свойства стволовой клетки сохраняются при контакте с базальной мембраной, также играющей роль ниши. Утрата этой связи ведет к образованию транзитного пула стволовых клеток с терминальной дифференцировкой. Такие группы клеток распределяются в виде гексагональных клеточных комплексов, и их потомки с периферии комплекса перемещаются в выше расположенные отделы, вплоть до ороговевающего слоя.
Таким образом, репаративный потенциал на уровне клеток выглядит следующим образом:
Для активации стволовых клеток необходимы цитокины, факторы роста и другие сигнальные молекулы, синтез которых регулируется как самими стволовыми клетками, так и их микроокружением – нишей, которая обеспечивает сигналы для выбора – сохранять идентичность стволовой клетке либо дифференцироваться в зрелые специализированные клетки.
С возрастом, подчиняясь правилу Хайфлика, уменьшается общее число стволовых клеток, участвующих в репаративном процессе, в особенности мезенхимальных75. Вследствие клеточного обеднения и снижения синтетической активности клеток кожи развивается и дефицит цитокинов, ростовых факторов, сигнальных, регуляторных молекул, как следствие, пролиферативная активность клеток падает. Становится очевидной роль сигнальных молекул в их взаимодействии с клетками.
Вообще способность клеток воспринимать сигналы и отвечать на них – фундаментальный признак жизни. У многоклеточных организмов клетки с различными функциями обмениваются широким разнообразием сигналов. Судя по всему, именно регуляторная функция сигнальных молекул и своевременная компенсация их возрастного и посттравматического дефицита открывает многообещающие перспективы для оптимизации топической терапии поражений и повреждений кожи, тем более что исследования в этом направлении уже показали результативность.
Коллективом ученых была исследована/проанализирована желеобразная эмбриональная субстанция пупочного канатика – источника эмбриональных стволовых клеток, пептидов, сигнальных молекул, факторов роста, фосфолипидов, энзимов, гликозаминогликанов, среди которых был, в частности, выделен полипептид Wharton Jelly Peptide P199, стимулирующий деление стволовых клеток. Вскоре были проведены исследования его воздействия на синтез сигнальных молекул, необходимых для активации пролиферации стволовых клеток кожи. Было доказано, что данный полипептид достоверно увеличивает в культуре клеток кожи человека количество цитокинов и ростовых факторов, создавая тем самым «каскад» сигнальных молекул, который необходим для активации процессов пролиферации и дифференцировки стволовых клеток. Однако в исследовании не указывались конкретные сигнальные молекулы, посредством которых осуществляется взаимодействие клеток между собой и последующее их деление76.
Вторая важная особенность механизмов передачи сигнала в клетках мишенях – усиление (амплификация) сигнала. Конечный ответ клетки на сигнал определяется числом исполнительных элементов клетки (ферментов, структурных белков, переносчиков и т. д.), на которые воздействует сигнал, причем, как правило, соотношение «непосредственный регулятор – исполнительный элемент» равняется 1:1. Если бы сигнальные молекулы прямо взаимодействовали с исполнительными элементами, то это потребовало бы огромных количеств сигнальных молекул, перемещаемых по крови от места их образования к клеткам мишеням. Выход из этого положения в создании механизмов усиления сигнала, с привлечением специальных молекул, получивших название вторичных посредников.
Еще одна важная особенность в механизме передачи сигнала в клетке мишени – «выключение» действия сигнала. Это достигается разными приемами, включенными в механизм передачи сигнала. Активирование рецептора при взаимодействии с сигнальной молекулой одновременно включает механизм обратной связи, который отключает рецептор (например, путем фосфорилирования молекулы рецептора) или удаляет рецептор с поверхности клетки (путем эндоцитоза), или используются специальные белки, прерывающие передачу сигнала (G-белки) и т. д. Другая особенность систем преобразования сигналов – интеграция, способность клетки, получая многочисленные и разнообразные сигналы, выдавать интегрированный ответ, соответствующий потребностям самой клетки или организма.
Различные пути передачи сигналов перекрещиваются друг с другом на нескольких уровнях, создавая множество взаимодействий, что обеспечивает гомеостаз клеток и организма как в физиологических условиях, так и при поражении кожи.
Поскольку заживление ран кожных покровов, результатом которого является восстановление внеклеточного матрикса и функционально активного эпителиального покрова, протекает посредством восполнения дефицита клеток и сигнальных молекул в области поражения кожи, мысль о внесении в рану кожи «внешнего» стартового сигнала (с целью компенсации возрастного и посттравматического дефицита сигнальных молекул для стимуляции начала пролиферации, последующей амплификации клеток росткового пула и, как следствие, повышения репаративной функции кожи) выглядит прогностически оправданной и перспективной. Логичен и поиск конкретной сигнальной молекулы, посредством которой может быть осуществлен стартовый сигнал к началу пролиферации клеток росткового пула.
Не случайно в рамках соответствия требованиям Федерального закона № 180-ФЗ «О биомедицинских клеточных продуктах» все вновь разрабатываемые продукты, содержащие клеточные линии, должны быть стандартизованы и главным методом оценки показателей качества биомедицинского клеточного продукта является метод проточной цитометрии77.
Отдельным видом прецизионной терапии, о которой шла речь выше, является применение биомедицинских клеточных продуктов, их дериватов и медицинских изделий на их основе. В мире уже существует ряд биомедицинских клеточных продуктов, разрешенных к применению, однако это – продукты на основе аллогенных клеток человека. При персонализированном подходе используются аутологичные клетки, т. е. клетки, при применении которых донор и реципиент – одно и то же лицо. Однако клетки и молекулы их активности могут быть получены из разных тканей других видов животных и могут быть использованы с разными целями. Например, создавать персонализированные продукты, т. е. реализовать классический принцип – лечить не болезнь, а больного – на основе современных технологизированных подходов. Тем более что развитие молекулярной биологии позволило создавать технологии получения идентичных эндогенным высокомолекулярные/х биологически активные/х белки/ов человека в промышленных объемах. Эта методология была основана на выделении или воспроизведении синтетическим путем ДНК, кодирующей требуемую белковую молекулу, перенос ее в живые клетки микроорганизмов или млекопитающих и активации гиперсекреции заданного продукта с параллельным наращиванием клеток-продуцентов в больших количествах. Многочисленные методические и технологические подходы к увеличению спектра и качества биомолекул были впоследствии объединены в отдельную научную и производственную область – биотехнологию78.
Именно в культурах клеток проводят мониторинг их пролиферации, анализируют их жизнеспособность, морфологию и дифференцировку в ответ на разнообразные стимулы, изучают межклеточные взаимодействия, способность к миграции в окружающие ткани, стимуляцию ангиогенеза и продуцирование молекул для создания новых лекарственных средств79, 80.
Изучение межклеточных взаимодействий восходит к работам А. Москоны, посвященным селективной самоагрегации эмбриональных клеток81, 82. М. Стейнбергом были продолжены исследования морфогенеза органов и тканей, основанного на дифференциальной адгезии клеток83, 84. Взаимосвязь эпителио-мезенхимальной пластичности культивированных клеток с морфогенезом показала возможность создания 3D-систем, в которых были минимизированы цитодифференцировка адгезированных клеток и вклад экстрацеллюлярного матрикса. В случае формирования клеточных сфероидов они восстанавливали организацию ткани через избирательные межклеточные взаимодействия, демонстрируя «универсальную реакцию на повреждение 85 и открывая беспрецедентные возможности использования соматического эмбриогенеза животных (ксеногенного по происхождению) при повреждении тканей.
Ксеногенной (от греч. ксено – чужой и genos – происхождение) называется ткань которой восполняют дефицит ткани человека, утраченной в процессе воспаления, поражения или повреждения. Но, это ткань не от другого человека и не искусственно выращенная, а получена от животного-донора другого биологического вида 86, которые в отличие от синтетических, не приводят к различным побочным эффектам 87.
Возможность использования ксеногенных объектов в качестве сырья для создания биотехнологических средств побуждает исследователей искать новые источники стволовых клеток и синтезируемых ими сигнальных молекул. Такими источниками являются, прежде всего, эмбриональные ткани животных, в качестве легко восполняемых сырьевых ресурсов 88.
При этом, традиционные подходы к ранозаживлению основываются на различных видах наружной терапии, направленной на скорейшее закрытие тканевого дефекта «любой ценой», в том числе и с формированием рубца. И поскольку основные звенья раневого процесса трактуются с позиций скрытой хронической аутоиммунной патологии 89, терапевтические мероприятия часто сводятся к общим антибактериальным и иммуносупрессивным воздействиям. Не учитывая прямое участие локального компартмента иммунной системы в регуляции процессов репарации тканей, представляя актуальность поиска способа стимуляции именно этих процессов.
На данном этапе следует уточнить терминологию, которая используется в характеристике процессов заживления кожи:
В процессе концептуализации был выделен видовой концепт, по отношению к которому была поставлена задача эмпирически найти определенный им фенотип для избирательной активации функций его клеток. Формула этого фенотипа определяется следующим термом:
Т8 = {t ∈ Х1 × X1 | ((∃d1 ∈ D) & ((∃d2 ∈ D) & (pr1t = pr1d1) & (pr2 t = pr1 d2) & (pr2 d1 ⋂ pr2 d2 ≠ Ø)}.
Этот терм определяет фенотипы субпопуляций, образованные из связанных клеток разного вида, имеющих хотя бы один общий признак.
Детали механизма возникновения такого фенотипа и управления его репарацией хорошо изучены. Он заключается в следующем. Начиная с ранних эмбриональных стадий развития кожи, клетки делятся симметрично и параллельно базальной мембране, обеспечивая увеличение кожного покрова у растущего эмбриона, формируя одноклеточный слой. В дальнейшем клетки на базальной мембране делятся также симметрично на себе подобных, которые остаются на мембране, и асимметрично – на дифференцирующиеся клетки так, что митотическое веретено направлено перпендикулярно к базальной мембране. Образующиеся дочерние клетки оказываются в неравных условиях, так как одна из них остается прикрепленной к базальной мембране, а другая нет. Те, что остаются на мембране, чувствительны к адгезивным молекулам и через взаимодействие последних с рецепторами факторов роста поддерживают пролиферацию. Другие же через транзиторную стадию вступают на путь дифференцировки и, двигаясь вверх, в дальнейшем превращаясь в ороговевшие кератиноциты, формируют многослойность эпидермиса. По другую сторону базальной мембраны обнаружены клетки с фенотипом, определенным как концепт Т8. Это фенотип CD34+. Его клетки при возникновении повреждения экспрессируют молекулы адгезии 92. Это ключевая область управления репарацией.
Общеизвестно, что молекулы межклеточной адгезии играют важную роль в репаративном процессе, являясь «языком общения» клеток. Распознать этот язык помогают CD, которые идентифицируют конкретный паттерн, выявляемый специфическим моноклональным антителом 93. Наиболее перспективной, при обсуждении вопросов репарации, является молекула межклеточной адгезии CD34+. Представляя собой трансмембранный мономерный гликопротеин, ее экспрессия напрямую связана с мультипотентностью мезенхимальных клеток-предшественниц всех пролиферативных клонов CD34+ 94, которые являются ключевыми в эпителизации ран 95, а их обнаружение свидетельствует о большом дифференциальном и репаративном потенциале ткани, о котором речь шла выше, и который характеризуется нарастающим возрастным и посттравматическим дефицитом.
CD34+ состоит из 385 аминокислот, обладает высоким уровнем гликозилирования, содержит единственный трансмембранный фрагмент и опосредует связывание стволовых клеток с внеклеточным матриксом тканей или напрямую со стромальными клетками. Активированная форма имеет дополнительный маркер CD 45dim. А сочетание маркеров обнаружения CD 34+ и CD 45dim широко используется в клинической практике репаративной медицины.
Таким образом, задача выделения функционально активных молекул для избирательной активации функций клеток кожи определенного фенотипа уточнилась конкретнее. Это позволило экспериментально выделить молекулу адгезии клеток фенотипа CD34+CD45dim ксеногенного происхождения для активации репаративной функции клеток in vivo.
Гипотеза о возможной стимуляции репаративных потенций в коже путем внесения вещества ксеногенного происхождения, предсказуемо воздействующего на механизм формирования грануляционной ткани, которая является обязательным этапом к эпителизации и формированию эстетического результата заживления, может быть реализована с возможностью исследования клеток фенотипа CD34+CD45dim. А их культивирование с целью получения необходимого количества функционально активных молекул может быть использовано при разработке биотехнологического средства для интенсификации репарации поврежденной кожи.
В упрощенном виде, процесс производства биотехнологического средства выглядит так: синтез действующего вещества, подбор вектора воздействия, подбор клеток-продуцентов, амплификация клеток-продуцентов и получение супернатанта, содержащего биотехнологический продукт, очистка с использованием высокоэффективных биохимических методов, создание лекарственной формы, стабилизация, упаковка, стандартизация по дозировке 96.
Разработка биотехнологического средства, сама по себе, обладает рядом преимуществ, главное из которых – это получение разнообразия фенотипически отличающихся клеток и экспериментальное, а затем и практическое, использование их функций при переносе к месту пораженного органа или ткани. Чрезвычайно важным аспектом ксеногенной клеточной терапии является сам перенос клеток и их способность интегрироваться в ткань и воспроизводить физиологические функции нормальных клеток.
После первых попыток пересадки роговицы от животных человеку ксенотрансплантаты стали рассматриваться в качестве потенциальной альтернативы аллотрансплантатам 97. Дальнейшие исследования были направлены на развитие ксенотрансплантации и изучение возможности использования изолированных клеток животных. Например, экспериментальные работы по пересадке свиных островковых клеток животным с индуцированным сахарным диабетом позволили установить межвидовую физиологическую активность и регулируемый метаболизм в тканях реципиента с нормализацией показателей гликемии 98. Это подтверждает возможность использования клеток-продуцентов, в качестве потенциального источника биологически активных молекул для лечения заболеваний человека, сопровождающихся поражением органов и тканей.
Несколько существенных преимуществ отмечено в отношении куриных эмбрионов, которые считаются не только безопасным источником донорских клеток для производства вакцин, но и позволяют получать клетки в неограниченном количестве при существующем не одно десятилетие строгом контроле за качеством клеточного материала 99. Преимущество использования клеток куриных эмбрионов становится особенно очевидным поскольку позволяет избежать целого ряда трудностей, присущих забору человеческой фетальной ткани: этические проблемы, недостаточный контроль над донорами, определение оптимального срока для выделения клеток, оценка качества донорской ткани, недостаточная изученность вопроса и законодательный запрет на использование фетальных тканей человека. Извлечение клеток куриных эмбрионов можно осуществлять в зависимости от требуемого срока гестации, что позволяет стандартизировать качество и жизнеспособность получаемых клеток-продуцентов необходимых молекул.
Отдельной проблемой, препятствующей нормальному функционированию пересаженных ксеногенных клеток, является отторжение трансплантата. Клеточная трансплантация не устраняет проблем, связанных с отторжением чужеродных тканей. Вместе с положительными результатами трансплантации клеток следует ожидать и эффекты чужеродности. При этом, данная проблема полностью исключена при переносе молекул, выделенных из гомогената клеток в виде супернатанта (надосадочной пробы). Возможность получения молекул в растворенном состоянии выгодно отличает молекулярную терапию от клеточной, поскольку не вызывает нежелательных эффектов иммунного распознавания белковых компонентов мембран донорских клеток.
Способ, с помощью которого можно выделить из смеси и осадить искомую молекулу за счет образования комплекса антиген-антитело получил название – иммунопреципитация. Развитие представлений об иммунопатогенетических механизмах раневого процесса перспективно может рассматриваться в виде попыток восполнить дефицит собственных клеток, активных молекул и даже тканей пациента 100 101, но учитывая необходимость использования ксеногенного переноса требует обеспечения биологическим сырьем.
В итоге, задача уточнилась окончательно и конкретно.
Разработать биотехнологическое средство для интенсификации репарации кожи in vivo, содержащее в качестве действующего вещества молекулы адгезии клеток фенотипа CD34+CD45dim ксеногенного происхождения.
Согласно статье 1 Регламента ЕС № 2001/393/EG1, SPF-эмбрион является свободным от специфических патогенных контаминантов – бактерий, грибов, вирусов и антител против этих микроорганизмов. В статье 2, пункте 2 Директивы Совета ЕС № 90/539/EWG2 сказано, что SPF-эмбрион может быть получен из птиц, свободных от специфических патогенных контаминантов по Европейской фармакопее и предназначен исключительно для использования в диагностических, научно-исследовательских или фармацевтических целях. С 1 февраля 2023 года в России начал действовать ГОСТ для инкубационных яиц, которые используются в качестве сырья. По мнению руководителя ФМБА России Вероники Скворцовой: «ФМБА России выступило экспертной организацией при разработке данного стандарта, так как Агентство имеет большой опыт применения яйца инкубационного, как сырья для производства гриппозных вакцин. Росстандарт утвердил его 29 декабря 2022 года. Строгие требования к сырью не случайны, ведь требуется обеспечить стерильные условия для содержания кур и производства яиц. Использование эмбрионов, полученных из яиц в соответствии с SPF, сводит риски заражения к нулю и открывает хорошие возможности для производства и экспорта».
Следовательно, главным этапом при разработке биотехнологического средства для интенсификации репарации стало выделение действующего вещества ксеногенного происхождения.
Для этого SPF-эмбрион курицы 6 дней гестации, проверенный на стерильность, поместили в криопробирки 2 мл с раствором для замораживания, содержащим 90 % Fetal Bovine Serum и 10% DMSO в качестве криопротектора. Замораживали в парах жидкого азота t°-40°C со скоростью 1°C в минуту. Охлажденные криопробирки с материалом помещали в жидкий азот (t°-170°C) в сосуды Дьюара.
Для приготовления суспензии замороженный материал ex tempora размораживали в парах азота для сохранения высокой жизнеспособности клеток, переносили в стерильную стеклянную, центрифужную пробирку, отмывали стерильным раствором натрия хлорида 0,9 % для удаления среды для замораживания, центрифугировали 10 минут при 1500 об/мин. Далее, удаляли супернатант, после чего отмывали второй раз. В пробирку к осадку доливали 3 мл раствора натрия хлорида 0,9 %, гомогенизировали. Затем доливали 5 мл раствора натрия хлорида 0,9 %.
Для осаждения стромы центрифугировали при 1500 об/мин.: клетки ткани мозга – 1 минуту, клетки печени и других тканей – 10 секунд. Супернатант переносили в стерильную пробирку и вновь центрифугировали в течение 5 минут при 1500 об/мин для осаждения клеток. Супернатант удаляли и к осадку добавляли 3 мл раствора натрия хлорида 0,9 %. Ресуспендировали и добавляли раствор натрия хлорида 0,9 % до 10 мл, центрифугировали 5 минут при 1500 об/мин.
В полученной суспензии определяли фенотип клеток, оценивали их жизнеспособность и цитоз. Жизнеспособность клеток с фенотипом CD34+CD45dim должна была составлять не ниже 80 %. Если этот показатель был ниже, то образец отбраковывался. Раствором натрия хлорида 0,9 % доводили концентрацию клеток в образце до 1,0´106+0,25´106 в 1мл.
Настоящее изобретение относится к физиологии, медицине, хирургии, травматологии, клинической фармакологии и может использоваться для изготовления биотехнологического средства, ускоряющего заживление ран различной этиологии после оценки эффективности воздействия его действующего вещества на процессы, прямо влияющие на репарацию. Было показано, что таковым является апоптоз, играющий важнейшую роль в процессах при заживлении ран 102. Если апоптоза не возникает, то воспалительные процессы продолжаются, поскольку из некротизированных клеток продолжают поступать провоспалительные факторы. Замедление же процессов апоптоза приводит к замене грануляционной ткани окончательной рубцовой тканью 103. На этом основании, понимание роли апоптоза в образовании рубцовой ткани может способствовать поиску новых подходов к управлению репарацией, посредством воздействия на иммунные механизмы регуляции гибели клеток.
Для проверки данного феномена, в качестве индуктора апоптоза использовали камптотецин, основой проапоптотического действия которого является подавление активности ДНК топоизомеразы I 104, в финальных концентрациях 1 и 0,2 мкМ. Исследуемое вещество вносили в финальных концентрациях 7,70 и 350 мкМ.
Культивирование клеток суспензионных культур THP-1 осуществляли с использованием среды RPMI-1640 с добавлением 10 % инактивированной эмбриональной телячьей сыворотки (ЭТС), 50 мкг/мл гентамицина и 2 мМ L-глутамина («Биолот», Санкт-Петербург). ЭТС остается эталонным компонентом среды для культивирования клеток, поскольку содержит питательный и гормональный компоненты, а также связывающие белки, которые необходимы для обеспечения пролиферации, дифференцировки и адгезии клеток 105 106.
Инкубацию клеток осуществляли в присутствии обоих стимуляторов. Время инкубации в присутствии стимуляторов составляло 24 часа при 37°С в атмосфере 5% СО2. Пересев производили каждые 2–3 дня. Для ведения клеток использовали пластиковые флаконы объемом 50 мл (Sarstedt, Германия). При постановке экспериментов в лунки 96-луночного плоскодонного планшета (Sarstedt, Германия) вносили 200 мкл клеточной суспензии (2×106 клеток в мл) в соответствующей полной культуральной среде. Для выявления относительного содержания клеток, находящихся на разных стадиях апоптоза, применяли два флуоресцентных красителя PI и YO-PRO-1 по описанной ранее методике 107.
При окраске клеток к 100 мкл клеточной суспензии (2–3×106 клеток/мл) добавляли раствор YO-PRO-1 (Invitrogen, США) в финальной концентрации 250 нМ и раствор йодистого пропидия (Sigma-Aldrich, США) в финальной концентрации 1 мкг/мл. Окраску проводили при комнатной температуре в течение 15 минут в защищенном от света месте. По завершении инкубации к образцам добавляли по 200 мкл ЗФР и анализировали на проточном цитометре Navios (Beckman Coulter, США). Для каждого из образцов анализировали не менее 20 000 одиночных клеток.
Концентрации камптотецина и вещества ксеногенного происхождения, использованные в работе, обозначали через множества и, соответственно, каждой паре значений (xi; yi) выделяли процентные значения величины гибели клеток на ранней стадии от апоптоза (zi) и на поздней стадии – от апоптоза и некроза (z'i). Таким образом, полученные две матрицы, в которых вектор-строки (xi; yi; zi) и (xi; yi; z'i) определяют точки, лежащие на двух поверхностях в трехмерном пространстве, обрабатывались с помощью языка программирования Python Software и модулей SciPy и Numpy. На первом этапе проводилось формирование узлов двумерной сетки с помощью функции numpy.meshgrid 109, а затем данные интерполировались с помощью функции scipy.interpolate.griddata 108. Графическое построение поверхностей выполнялось с помощью модуля Matplotlib. Результаты выражали в виде процентов позитивных клеток.
Математическую обработку цитометрических данных проводили при помощи программного обеспечения EXPO-32, CXP v.2.2, Navios Software v.1.2 и Kaluza™ v.1.2 (Beckman Coulter, США) и Statistica 8.0 (StatSoft, США).
В контрольных образцах клеток линии ТНР-1 относительное содержание живых клеток составляло 96,53±0,46 %. Внесение вещества в финальной концентрации 350 мкг/мл сопровождалось достоверным снижением (р<0,001) относительного содержания жизнеспособных клеток до 91,72±0,44 %. Более того, отмечено достоверное увеличение относительного содержания клеток, находящихся на ранних стадиях апоптоза (3,16±0,19 % против 1,99±0,39 % в контроле, р=0,024), а также погибших клеток (поздний апоптоз/некроз), показавших превышение более чем в 4 раза при сравнении с контрольными образцами (5,12±0,28 % и 1,47±0,21 % соответственно, р<0,001).
Вещество в финальной концентрации 70 мкг/мл показало достоверное двукратное увеличение (р=0,009) клеток, находящихся на терминальных стадиях апоптоза и в некрозе (2,69±0,29 %). В финальной концентрации 7 мкг/мл не показало достоверное влияние ни на один из исследованных показателей.
Внесение в среду для культивирования камптотецина, индуктора апоптоза, в финальной концентрации 1 мкМ сопровождалось снижением (р<0,001) относительного содержания жизнеспособных клеток до 31,58±1,68 %, а также увеличением относительного содержания клеток на ранних и поздних стадиях апоптоза (до 30,12±1,94 % и 38,30 % соответственно). Вместе с тем в присутствии препарата в финальной концентрации 350 мкг/мл уровень жизнеспособных клеток увеличивался (р=0,001) и достигал значений в 45,11±2,17 %. Более того, относительное содержание ТНР-1, находящихся на ранних стадиях апоптоза, снижалось до 21,49±2,15 % (р=0,018), а клеток, находящихся на стадии позднего апоптоза и некроза – до 33,40±2,49 % (р=0,165). Внесение препарата в концентрациях 70 и 7 мкл/мл не оказывало достоверного влияния на распределение клеток по фазам апоптоза (рис. 57 и рис. 58).
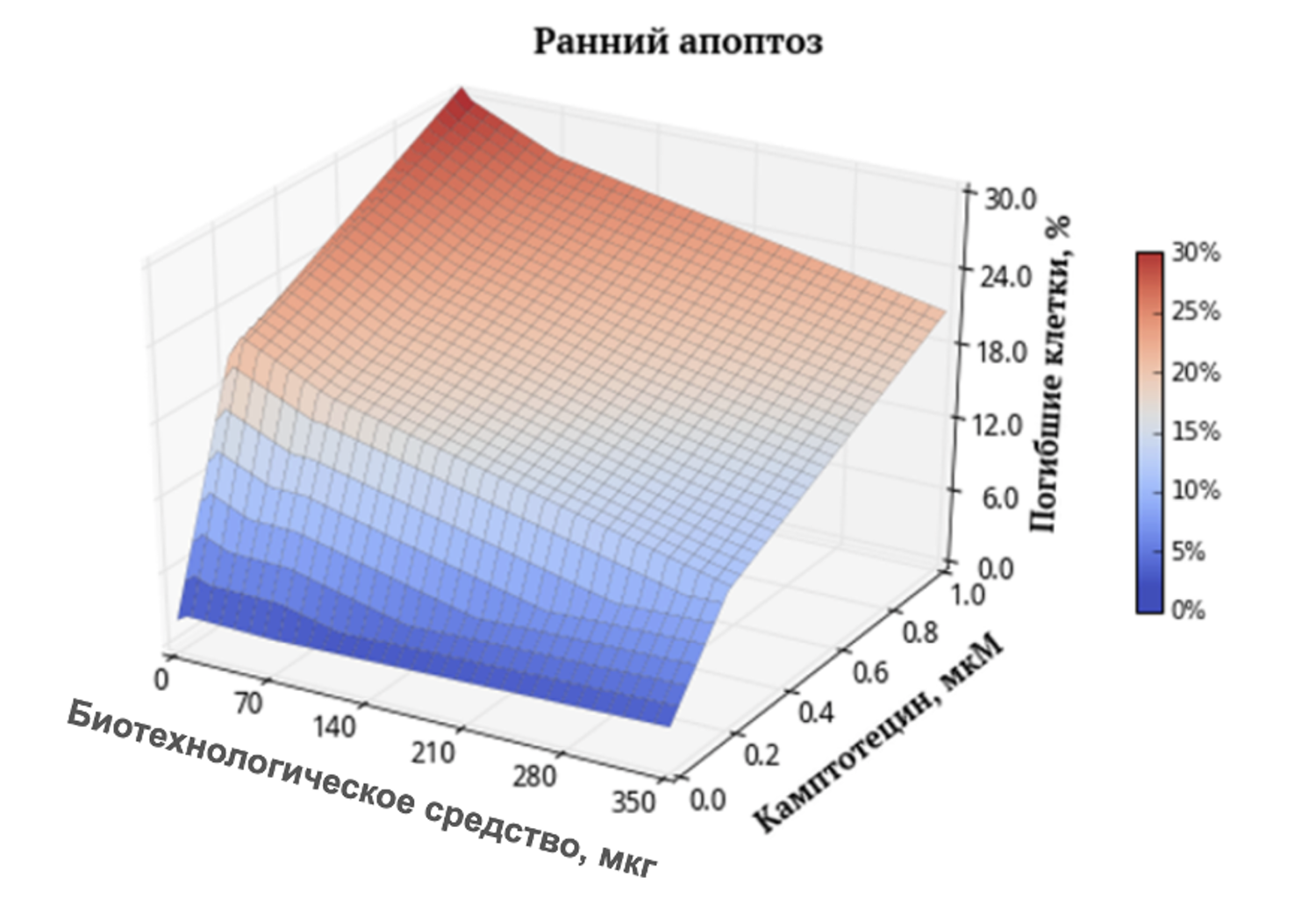
Рисунок 57. Характеристика зависимости раннего апоптоза клеток от концентраций веществ. Градиентная заливка поверхности позволяет оценивать отдельное и комбинированное действие биотехнологического средства и камптотецина. Синим цветом обозначены области с низким процентом гибели клеток, а красным – области с высоким процентом гибели.
На 3D-диаграмме представлена визуализация зависимости уровня раннего апоптоза клеток (в %) от концентраций двух факторов:
по оси X — концентрация биотехнологического средства, мкг;
по оси Y — концентрация камптотецина, мкМ;
по оси Z (вверх) и градиенту цвета — процент погибших клеток, находящихся на стадии раннего апоптоза.
Интерпретация диаграммы:
Биотехнологическое средство в диапазоне 0–350 мкг: при нулевых концентрациях камптотецина, даже максимальные дозы средства не вызывают значительного апоптоза (менее 5–10% погибших клеток). Это указывает на низкую цитотоксичность средства в монотерапии.
Камптотецин (0–1.0 мкМ): с увеличением его концентрации наблюдается нарастание процента погибших клеток, особенно на фоне отсутствия БТ-средства — т.е. камптотецин сам по себе индуцирует апоптоз.
Наибольшая гибель клеток (25–30%) регистрируется при совместном воздействии высоких концентраций обоих веществ.
Поверхность графика в этих зонах окрашена в красные оттенки, что свидетельствует о сильной синергии: комбинация камптотецина и биотехнологического средства вызывает значительно более выраженный апоптоз, чем каждое вещество по отдельности.
Цветовая шкала (градиент):
Синий (0–5%) — минимальный апоптоз, клетки преимущественно жизнеспособны.
Фиолетово-розовые (10–20%) — умеренный уровень апоптоза.
Красный (25–30%) — высокая степень гибели клеток.
Таким образом, биотехнологическое средство само по себе не оказывает выраженного цитотоксического эффекта, но значительно усиливает апоптотическое действие камптотецина.
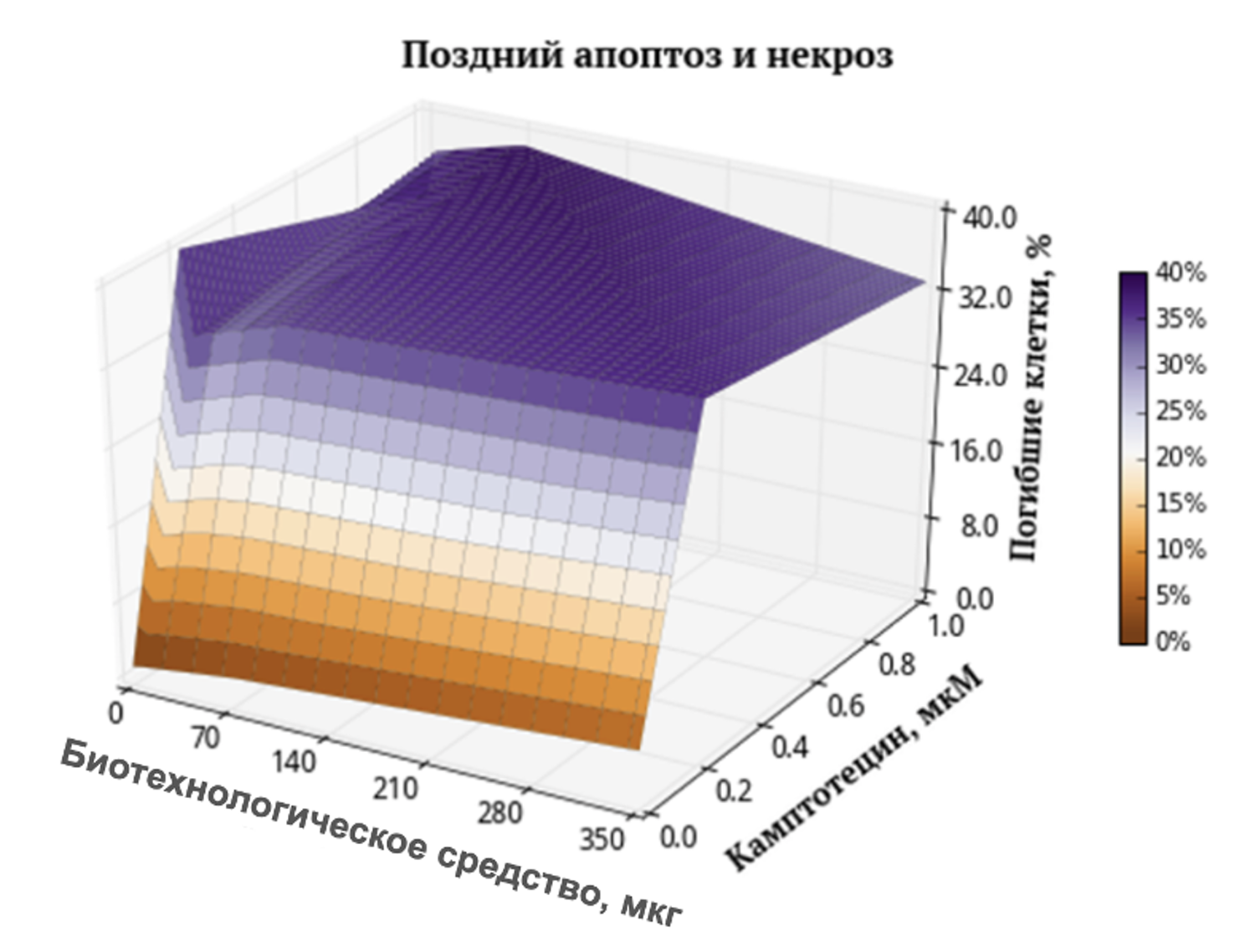
Рисунок 58. Характеристика зависимости позднего гибели клеток в результате апоптоза и некроза от концентраций веществ. Коричневым цветом обозначены области с низким процентом гибели клеток, а фиолетовым – области с высоким процентом гибели.
Следующая 3D-диаграмма иллюстрирует зависимость поздней гибели клеток (апоптоз и некроз) от концентраций биотехнологического средства и камптотецина. Точнее, здесь представлена пространственная зависимость процента клеток, погибших в стадии позднего апоптоза и/или некроза, от двух факторов:
Ось X: концентрация биотехнологического средства (мкг);
Ось Y: концентрация камптотецина (мкМ);
Ось Z: процент погибших клеток (%), отображён также цветовой шкалой;
Цветовая заливка: от тёмно-коричневого (низкий уровень гибели) до тёмно-фиолетового (высокий уровень гибели).
Ключевые наблюдения:
При нулевой концентрации камптотецина (ось Y), даже при высоких дозах биотехнологического средства (до 350 мкг), уровень поздней гибели клеток остаётся низким — до 5–10% (область коричневого цвета).
Это указывает на безопасность биотехнологического компонента при моноиспользовании, без токсических эффектов.
С увеличением концентрации камптотецина от 0 до 1 мкМ, даже при низких дозах биотехнологического средства, наблюдается значительное увеличение гибели клеток — до 30–40%.
Это соответствует известной цитотоксичности камптотецина как химиопрепарата, вызывающего позднюю гибель через каскад апоптоза и некроза.
При сочетании высоких доз камптотецина и биотехнологического средства, гибель клеток достигает максимума (до 40%) — область окрашена в тёмно-фиолетовый.
Однако форма поверхности показывает, что плато максимальной гибели достигается быстрее при наличии обоих компонентов — возможно, присутствует потенцирующий эффект, усиливающий действие камптотецина.
Интерпретация цветовой шкалы:
Коричневые оттенки (0–5%) — низкий уровень некроза/апоптоза;
Жёлто-светло-серые (10–25%) — умеренная гибель клеток;
Фиолетовые (30–40%) — высокая клеточная гибель, максимальная токсичность.
Таким образом, биотехнологическое средство не индуцирует позднюю клеточную гибель самостоятельно, но может усиливать токсичность камптотецина. Представленная диаграмма позволяет оценить терапевтическое окно и потенциальные риски, а также выявить зоны безопасности и синергии. График является наглядным инструментом для оптимизации дозировок и построения режимов комбинированной терапии, где минимизация позднего апоптоза/некроза особенно важна.
В рамках эксперимента концентрация камптотецина была понижена до 0,2 мкМ, что привело к увеличению относительного содержания живых клеток до 47,76±3,17 %, тогда как на ранних и поздних стадиях апоптоза находилось уже 20,75±2,40 % и 31,49±1,31 % клеток соответственно. Инкубация ТНР-1 в присутствии камптотецина и препарата в финальной концентрации 350 мкг/мл достоверно не влияла на жизнеспособность клеток (51,11±1,49 %, р=0,367), однако сопровождалась почти двукратным снижением относительного содержания клеток, находящихся на ранних стадиях апоптоза (до 12,86±2,00 при р=0,036). По остальным концентрациям вещества достоверных изменений жизнеспособности клеток линии ТНР-1 отмечено не было.
Это указывает на существенное снижение общей цитотоксичности биотехнологического средства при минимально эффективной дозе камптотецина. Несмотря на наличие апоптозных процессов, снижение концентрации позволяет удерживать значимую долю клеток в жизнеспособном состоянии, что открывает потенциал для оптимизации дозировки в комбинированной терапии. Отсюда, краткие выводы:
Снижение дозы камптотецина до 0,2 мкМ значимо повышает выживаемость клеток; не исключает апоптоз, но снижает его глубину и скорость; даёт возможность избежать некроза, ассоциированного с воспалением и повреждением ткани.
В сочетании с биотехнологическим средством достигается лучший баланс между терапевтической активностью и безопасностью.
В результате проведенного исследования были получены данные о дозозависимом влиянии концентрации выделенного действующего вещества ксеногенного происхождения на жизнеспособность и процессы апоптоза клеток в культуре 110.
Обобщающее сравнение двух диаграмм (ранний апоптоз и поздний апоптоз + некроз) выглядит так:
|
Параметр |
Ранний апоптоз |
Поздний апоптоз и некроз |
|---|---|---|
|
Ось Z (показатель) |
% клеток в раннем апоптозе |
% клеток в позднем апоптозе / некрозе |
|
Минимальная гибель |
<5% (при нулевых концентрациях) |
<5% (при нулевых концентрациях) |
|
Максимальная гибель |
до ~30% |
до ~40% |
|
Эффект камптотецина |
Выражен дозозависимый рост |
Резкий скачок даже при низких дозах |
|
Эффект биотехсредства |
Незначительный сам по себе |
Незначительный сам по себе |
|
Комбинированное действие |
Потенцирует эффект камптотецина |
Потенцирует эффект камптотецина |
|
Цветовая шкала |
Синий → Красный (0–30%) |
Коричневый → Фиолетовый (0–40%) |
|
Форма поверхности |
Плавный наклон |
Резкий подъём, затем плато |
|
Токсикологический профиль |
Умеренный, обратимый (ранняя стадия) |
Значимо выражен, необратимый (некроз) |
На двух диаграммах представлены 3D-зависимости гибели клеток в ответ на комбинированное воздействие биотехнологического средства и камптотецина. Диаграммы различают раннюю (программированную, потенциально обратимую) и позднюю (поздний апоптоз/некроз — уже необратимую) формы клеточной гибели.
Основные выводы:
Само по себе биотехнологическое средство не индуцирует выраженную клеточную гибель ни на ранней, ни на поздней стадии.
Камптотецин демонстрирует дозозависимую токсичность, особенно в поздней фазе (до 40% погибших клеток).
При комбинированном воздействии (даже при умеренных концентрациях) наблюдается синергетический эффект, усиливающий апоптоз.
Поверхности графиков позволяют определить терапевтическое окно: концентрации, при которых достигается достаточная активность при минимальной цитотоксичности.
Репаративный процесс может быть управляемым, что позволило спланировать эксперимент заживления ран у лабораторных животных.
В экспериментальной части исследования было задействовано 80 лабораторных животных – половозрелые кролики-самцы породы Шиншилла, полученные из питомника г. Тюмени. Содержание и экспериментальные процедуры проводились в соответствии с правилами Совета Европейского сообщества (Директива 86/609/ЕЕС от 24.11.1986). Конкретно, животные содержались в виварии в индивидуальных клетках при одинаковом световом, температурном режимах и получали обычный рацион питания согласно установленным нормам. Эксперимент выполнен в осенне-зимний период. Животных выводили из эксперимента под эфирным наркозом с соблюдением правил эвтаназии.
Экспериментальные полнослойные кожные раны наносились однотипно всем животным. Использовалась модель инфицированной раны мягких тканей (Патент РФ № 2006122640). Операция проводилась под эфирным наркозом. На спине животного, в межлопаточной области по паравертебральной линии, вначале выстригался, а затем с помощью безопасной бритвы тщательно выбривался волосяной покров. С помощью металлической̆ пластины с внутренним диаметром кольца 2,0 см, иссекали шкуру на участке площадью 250 мм2 (рис. 59).

Рисунок 59. Подготовка лабораторного животного к эксперименту с моделированием инфицированной̆ раны мягких тканей
Полученный̆ дефект обрабатывали 70 % уксусной кислотой до получения некроза подкожной клетчатки и мышц (рис. 60).
Рисунок 60. Состояние ран после обработки 70 % уксусной кислотой, первые сутки эксперимента.
Затем в рану вносили 500 тыс. КОЕ St. Aureus. Спустя двое суток, к началу эксперимента, у всех животных были сформированы раны неправильно округлой формы до 200 мм2 (рис. 61).
Рисунок 61. Моделирование инфицированной раны мягких тканей
Вокруг раны образовался очаг инфильтрации – до 300 мм2. Стенки раны гиперемированы, плотные, спаяны с окружающими тканями, дно покрыто плотным налетом фибрина, выделяется до 2–3 мл гнойного отделяемого белесоватого цвета тестоватой консистенции.
В день формирования раны, под местной анестезией, выполняли биопсию раны через все слои на глубину до 1,8–2,2 см. Материал фиксировали в 96 % этиловом спирте, заливали в парафин и готовили гистологические срезы, которые окрашивали гематоксилином Майера и эозином с последующим анализом морфологической картины 111.
До начала лечения у всех животных при гистологическом исследовании определялись очаги некроза в соединительной и мышечной тканях (рис. 62), расширение кровеносных сосудов со стазом крови, экссудация лейкоцитов.
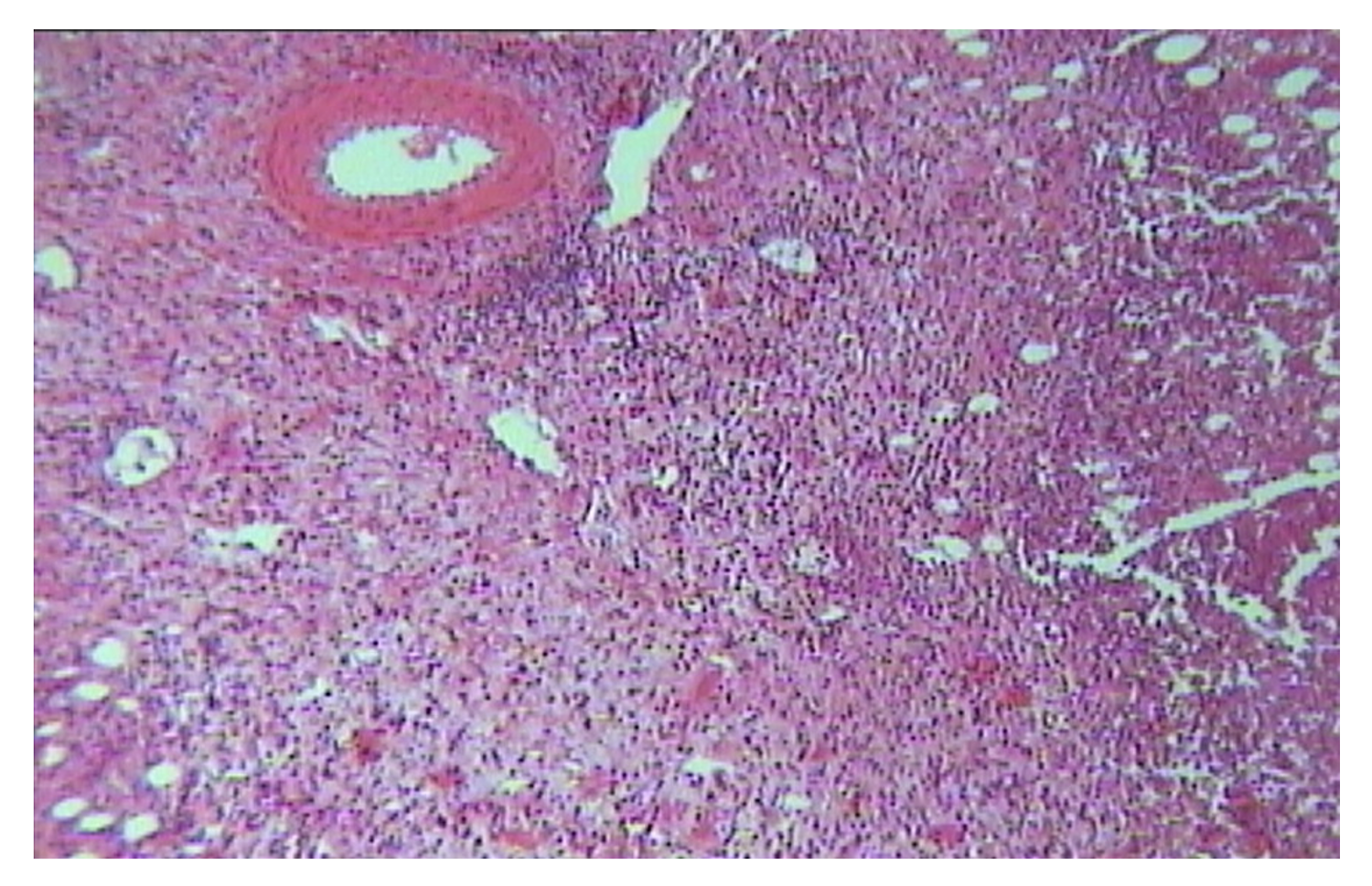
Рисунок 62. Характеристика ран до начала лечения. Окраска – гематоксилин Майера и эозин. УвХ 40. Очаги некроза в соединительной и мышечной тканях.
Сосочковый слой дермы имел четкое разграничение на слои с выраженной клеточной инфильтрацией, представленной моноцитами, единичными макрофагами и рыхлой соединительной тканью с большим количеством фиброцитов, единичными фибробластами, единичными моноцитами, плазмоцитами, очаги некроза замещены полиморфно-ядерными лейкоцитами, при этом также определяются и мононуклеарные лимфоциты (рис. 63).
Рисунок 63. Характеристика ран до начала лечения. Окраска – гематоксилин Майера и эозин. УвХ 40
Лечение животных начинали через пять суток после формирования инфицированной раны мягких тканей. Животные были разделены на четыре группы: экспериментальная группа и три группы контроля, по 20 кролов в каждой. Заживление ран проводилось открытым способом. В каждой группе один раз в сутки выполняли перевязку с определенным для каждой группы типом лечения:
При визуальном наблюдении в процессе заживления ран были отмечены некоторые отличия общего состояния и поведения животных сравниваемых групп. Характерной особенностью поведенческих реакций животных экспериментальной группы было усиление двигательной активности, увеличение объема потребляемой пищи и улучшение состояния шерстного покрова.
На первые, третьи, пятые, седьмые, десятые и пятнадцатые сутки оценивали размеры раневого дефекта, наличие отека, гиперемии, отделяемого из раны и его характер.
Во всех группах контроля в первые сутки раны сохраняли свои размеры. При этом стенки ран сохраняли свою плотность, были спаяны с окружающими тканями, вокруг раны сохранялся плотный инфильтрат, при механическом воздействии из раны выделялся гной, дно раны было покрыто гнойной пленкой (рис. 64).
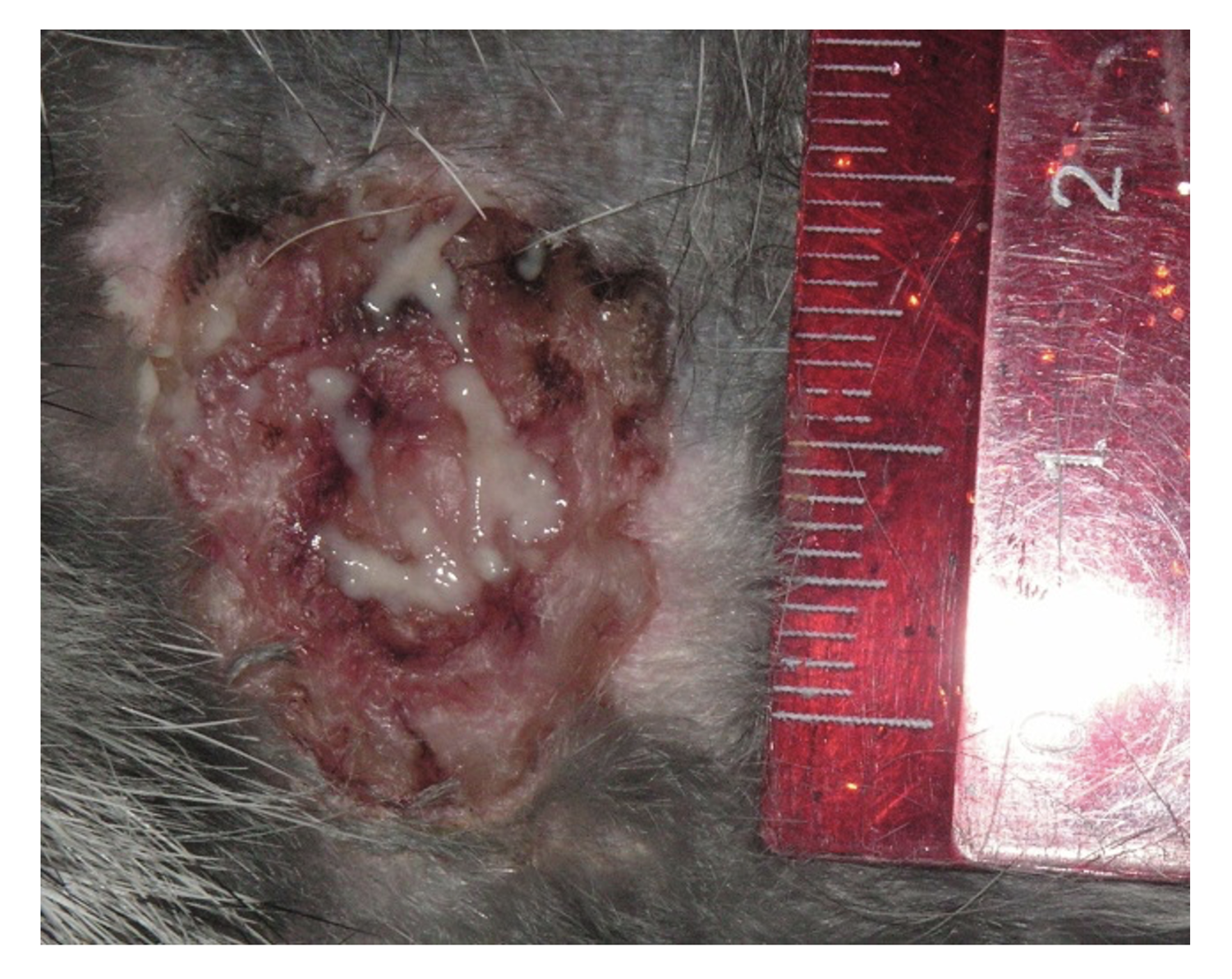
Рисунок 64. Состояние инфицированной раны мягких тканей в первые сутки эксперимента
В первые сутки в группе I (экспериментальной) раневой дефект сохранял свои размеры до 150 мм2. Вокруг раны сохранялась умеренная гиперемия кожи, стенки раны были мягкие при пальпации, дно раны было покрыто налетом фибрина, гноя не наблюдалось (рис. 65).
Рисунок 65. Состояние инфицированной раны мягких тканей животных в группе I (экспериментальной). Первые сутки лечения
На третьи сутки наблюдалось уменьшение размеров дефекта ткани до 60 мм2, рана покрыта струпом бледно-серого цвета, вокруг зона краевой эпителизации до 5,0 мм шириной (рис. 66).
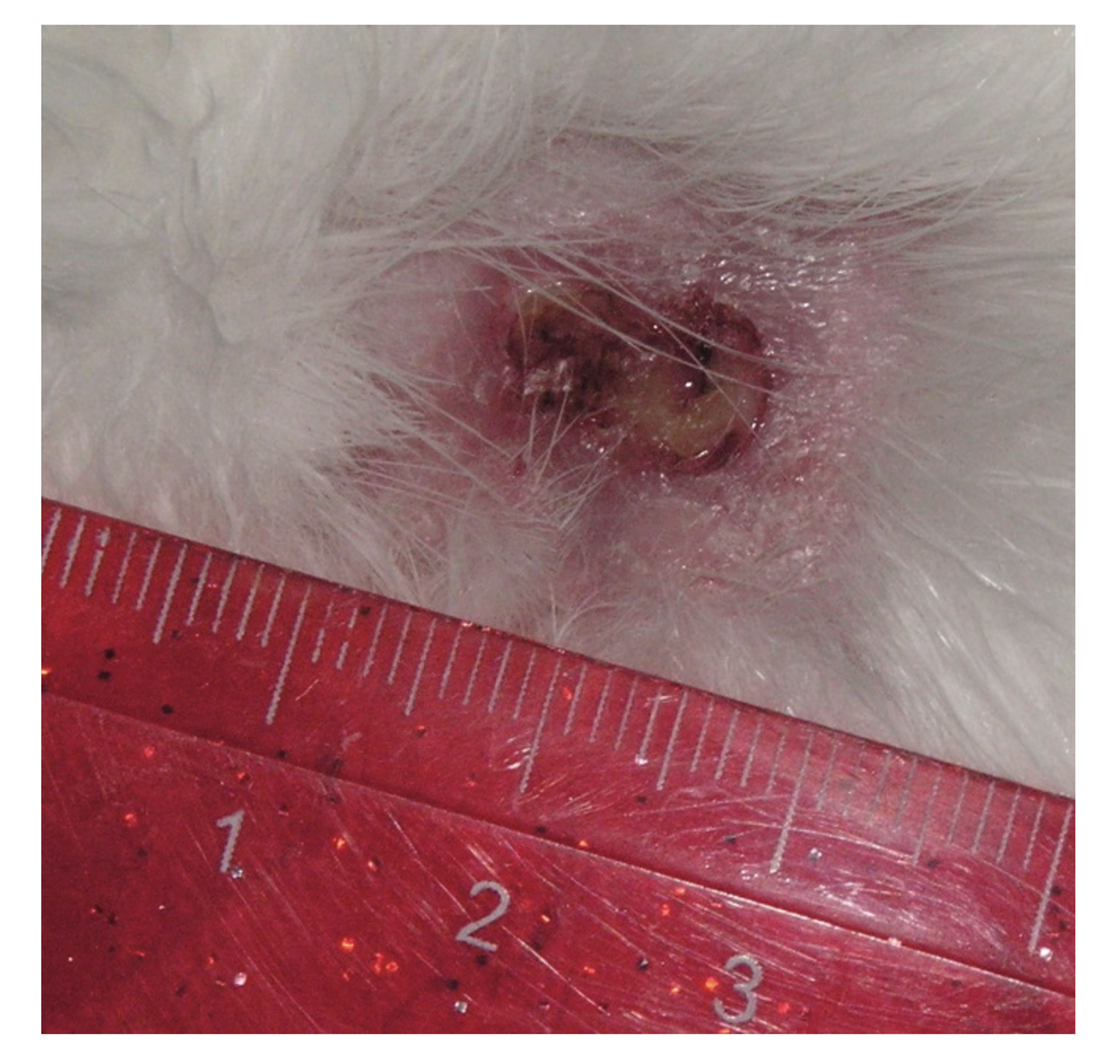
Рисунок 66. Состояние инфицированной раны мягких тканей в группе I (экспериментальной). Третьи сутки эксперимента.
В экспериментальной группе I на пятые сутки эксперимента наблюдалось закрытие раны более чем на 70 % и отмечалась краевая эпителизация с оволосением (рис. 67).
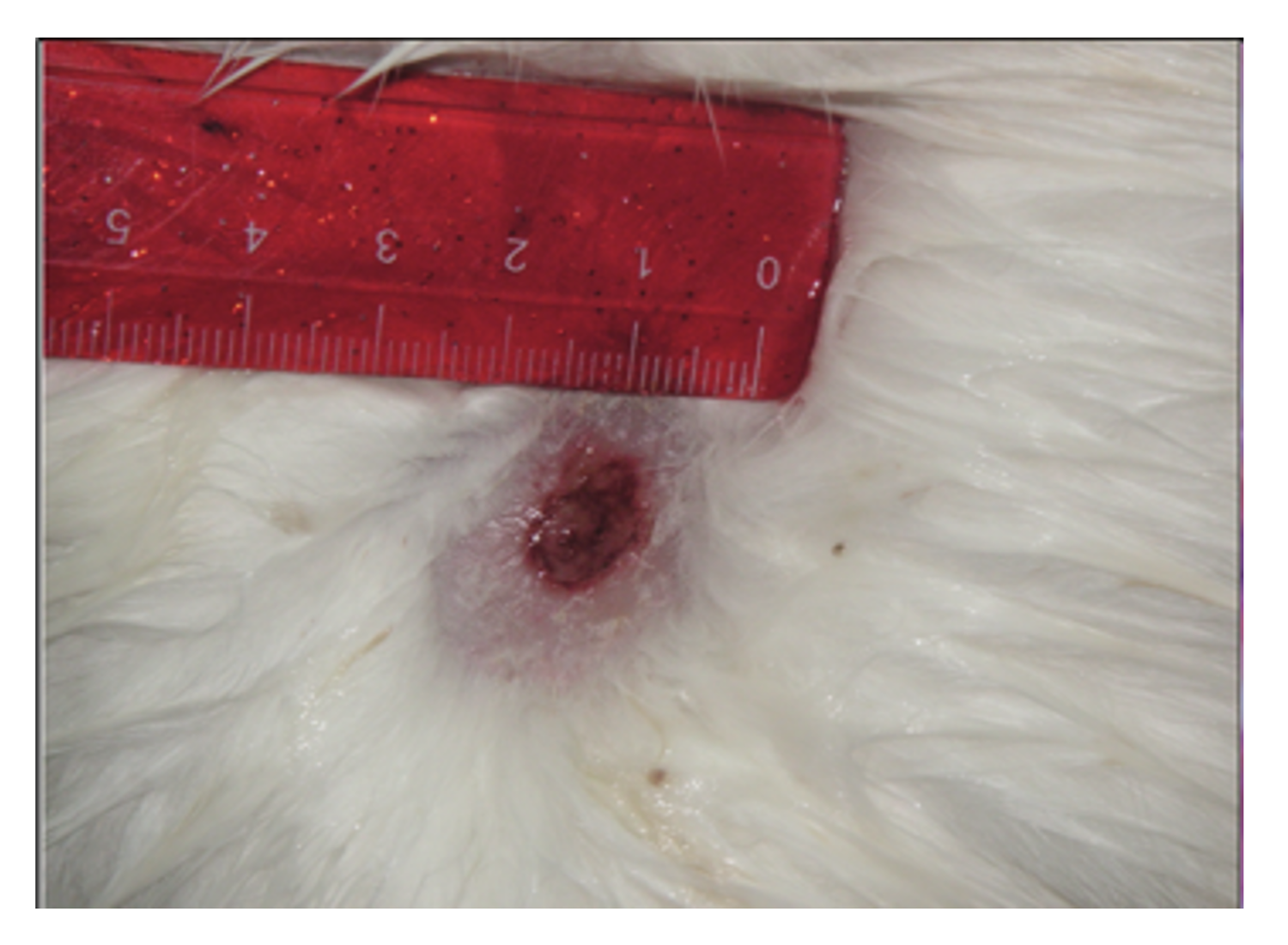
Рисунок 67. Состояние инфицированной раны мягких тканей в группе I животных. Пятые сутки эксперимента.
В экспериментальной группе I на десятые сутки эксперимента наблюдалась полная эпителизация раневого дефекта с его оволосением, гистологическая картина эпителизации раны с сохранением всех функционирующих структур. Эпителизация раны происходила без образования соединительнотканного рубца с восстановлением функции поврежденного участка, подтверждаемой ростом волосяного покрова (рис. 68).
Рисунок 68. Состояние инфицированной раны мягких тканей животных в экспериментальной группе I. Десятые сутки эксперимента.
У животных II группы (контроль основы) раны сохраняли свои размеры до десяти суток эксперимента, при гистологическом исследовании определялся отек, лимфогистиоцитарная инфильтрация и дегенеративно-дистрофические изменения подкожной клетчатки, мышечного слоя (рис. 69). Закрытие раневого дефекта не происходило. Как видно на фото, в эти сроки несколько сокращались размеры раневого дефекта (180-200 мм2), рана была покрыта налетом фибрина, края и стенки раны были плотные.

Рисунок 69. Состояние инфицированной раны мягких тканей в II группе животных (контроль основы). Десятые сутки эксперимента. 25 сутки эксперимента.
В группе III (традиционное лечение) в течение раневого процесса прослеживались все фазы: экссудации, пролиферации и регенерации (рис. 70).
Рисунок 70. Состояние инфицированной раны мягких тканей в III группе животных (традиционное лечение). 20 сутки эксперимента.
Закрытие раневого дефекта произошло к 25 суткам с формированием грубого соединительнотканного рубца (рис. 71).
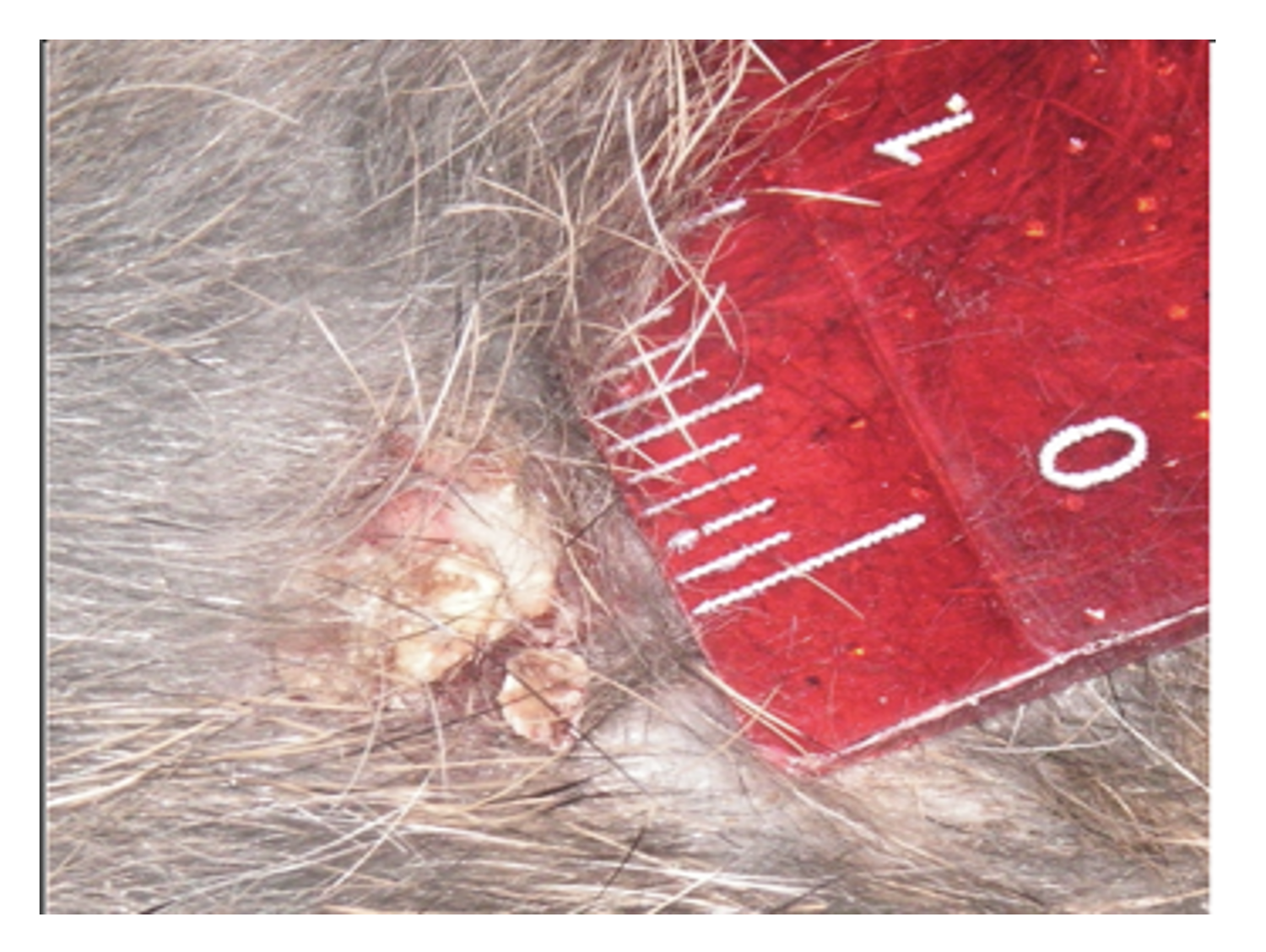
Рисунок 71. Состояние инфицированной раны мягких тканей в III группе животных (традиционное лечение). 25 сутки эксперимента.
В группе IV у пяти животных на 5 сутки развилась флегмона подкожной клетчатки, что привело к гибели животных (рис. 72).
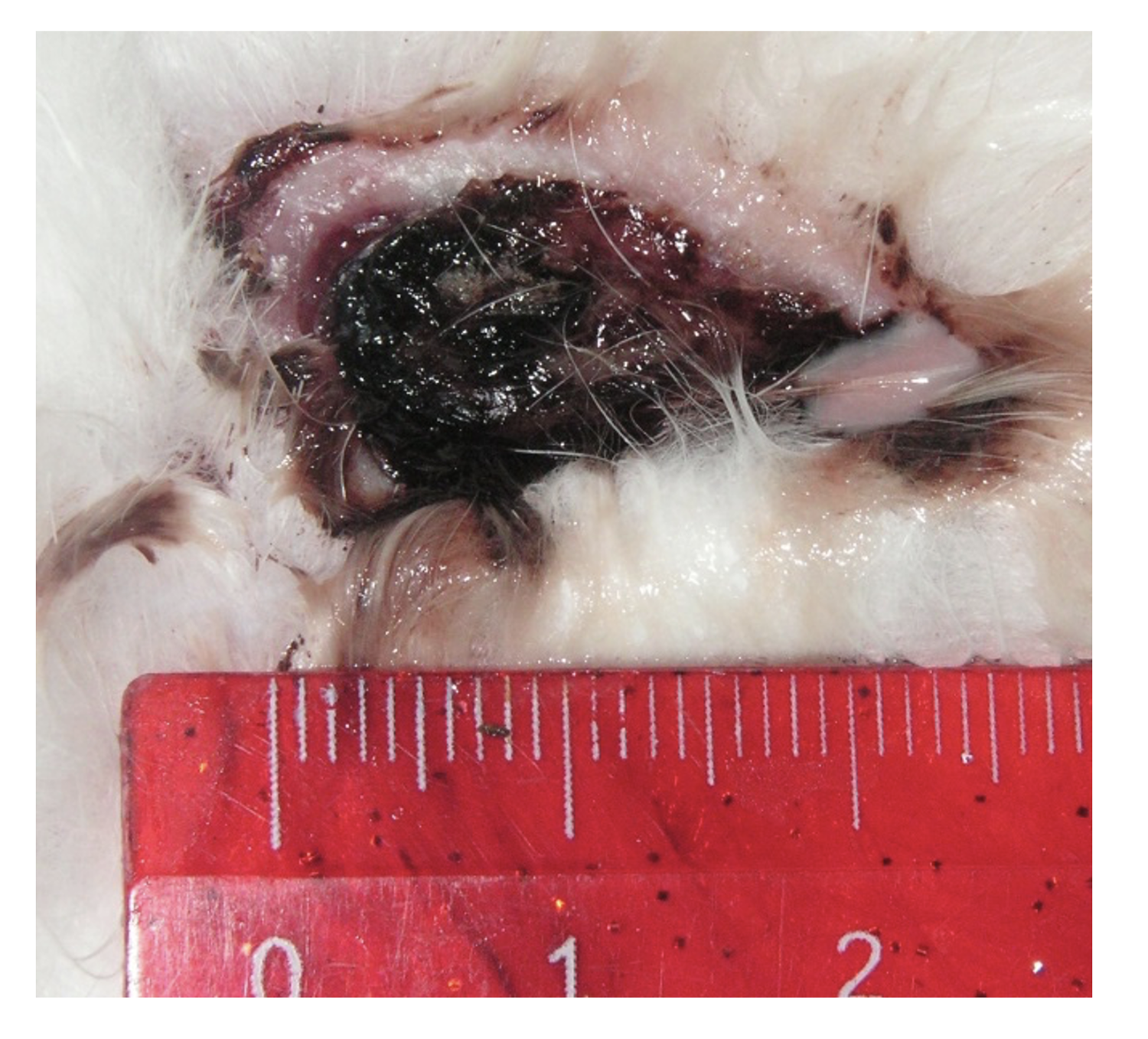
Рисунок 72. Состояние инфицированной раны мягких тканей. 25 сутки эксперимента. Группа IV. Раны сохраняют свои размеры, дно раны покрыто некротическими массами, из раны обильно выделяется гнойное отделяемое.
У оставшихся животных добиться закрытия раневого дефекта к 25 суткам эксперимента не удалось и животные были выведены из эксперимента
В экспериментальной группе (I) после применения действующего вещества, очищение раны от гнойно-некротических тканей происходило на 1–3 сутки лечения, а эпителизация раневого дефекта заканчивалась к 5–7 суткам эксперимента, с восстановлением волосяного покрова. В группах контроля очищение раны от гнойно-некротических тканей происходило к 15–20 суткам (группа II – контроль основы), закрытие раневого дефекта с формированием грубого соединительнотканного рубца – к 20–30 суткам (группа III – традиционное лечение) (рис. 73).

Рисунок 73. Визуальное сравнение динамики состояний при лечении инфицированной раны мягких тканей. Группа III (традиционное лечение) – верхний ряд и группа I (экспериментальная) – нижний ряд.
Для оценки скорости заживления раны у животных использовался тест Л. Н. Поповой 112 с некоторыми улучшениями 113. Укладывали на рану пластинку стерильного целлофана и чернилами обрисовывали ее контур. Затем целлофан с нанесенным контуром клали на миллиметровую бумагу и путем подсчета квадратных миллиметров внутри контура определяли площадь раны. При повторном исследовании таким же образом определяли площадь раны и устанавливали процент уменьшения ее за сутки по отношению к площади, вычисленной при предыдущем исследовании по формуле:
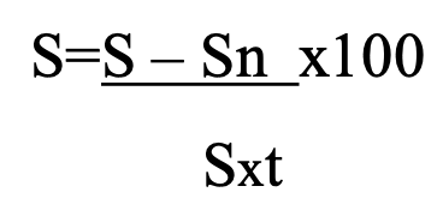
где S – величина площади раны при предшествующем измерении; Sn – величина площади раны в настоящий момент; t – число дней между первым и последующим измерениями.
Таблица 8. Сравнительная характеристика размеров площади ран на последовательных этапах заживления.
|
День наблюдения |
Площадь ран, мм2 |
|||
|
Группа I |
Группа II |
Группа III |
Группа IV |
|
|
0 |
230±2,7 |
228±,0 |
222±1,3 |
225±2,4 |
|
1 |
156±2,5 |
220±2,2 |
218±1,5 |
245±2,5 |
|
2 |
132±2,3 |
218±2,3 |
210±1,6 |
311±2,5 |
|
3 |
Очищение раны |
218±2,9 |
204±1,2 |
325±3,7 |
|
4 |
62±2,1 |
214±2,2 |
190±1,7 |
328±3,4 |
|
5 |
49±1,9 |
216±2,4 |
186±1,8 |
330±3,2 |
|
6 |
38±1,9 |
214±2,6 |
169±1,3 |
Животные выведены |
|
7 |
Эпителизация |
214±2,3 |
145±1,7 |
|
|
8 |
212±2,6 |
140±1,2 |
||
|
9 |
212±2,7 |
136±1,9 |
||
|
10 |
210±2,4 |
130±1,4 |
||
|
11 |
208±2,6 |
118±1,7 |
||
|
12 |
208±2,8 |
116±1,2 |
||
|
13 |
194±2,0 |
103±1,5 |
||
|
14 |
186±2,2 |
98±1,0 |
||
|
15 |
Очищение раны |
82±1,3 |
||
|
16 |
165±2,1 |
80±1,2 |
||
|
17 |
142±2,4 |
79±1,7 |
||
|
18 |
126±2,8 |
74±1,1 |
||
|
19 |
124±2,0 |
60±1,4 |
||
|
20 |
Рубец |
Очищение раны |
||
|
21 |
58±1,7 |
|||
|
22 |
49±1,3 |
|||
|
23 |
30±1,5 |
|||
|
24 |
15±1,1 |
|||
|
25 |
Рубец |
|||
* наблюдаемые различия статистически значимы – p<0,05
Уже в первый день в группе I площадь ран уменьшается до 156±2,5 мм², тогда как в других группах остается около 218–245 мм² – это различие статистически значимо.
На 2–6 день в группе I площадь ран уменьшается до 38±1,9 мм², в то время как в группах II–III значения остаются на уровне 169–218 мм², а в IV группе даже увеличиваются. Это тоже статистически значимые различия.
В группе III эпителизация и рубцевание происходят к 20–25 дню, а в группе I процесс завершается гораздо раньше (к 7 дню).
Во II группе значения остаются практически стабильными (214–228 мм²) вплоть до 13 дня, что статистически отличается от динамики I и III групп.
В IV группе на фоне выведения животных данные фиксируются лишь частично, но тенденция противоположная: увеличение площади ран (до 325–330 мм²), что тоже достоверно отличается от других групп.
Если кратко, то статистически значимые различия (p<0,05) следующие:
Таким образом, эффект применения вещества ксеногенного происхождения на данном этапе наблюдений позволяет сделать вывод об его стимулирующем влиянии на репарацию. Визуальные наблюдения были сопоставлены с гистологическими изменениями ран.
При гистологическом исследовании, на третьи сутки у животных в экспериментальной группе I в ране определялась рыхлая соединительная ткань с лейкоцитарной инфильтрацией, единичными укрупненными фибробластами, лимфоцитами, плазмоцитами, эозинофилами и моноцитами. Очаги пролиферации эндотелия сосудов были без просвета, с многорядностью расположения ядер (рис. 74).
Рисунок 74. Экспериментальная группа I. Пятые сутки эксперимента. Окраска гематоксилин Майера и эозин. УвХ 90
На 10 сутки эксперимента гистологически отмечалась пролиферативная активность клеток фибробластического ряда, трубчатая пролиферация фибробластов и эндотелия сосудов. В подкожной клетчатке определялись неповрежденные нервные стволики, что соответствовало гистологической картине эпителизации раны с сохранением всех функционирующих структур (рис. 75).
Рисунок 75. Экспериментальная группа I. Десятые сутки эксперимента. Окраска гематоксилин Майера и эозин. Увеличение 20.
У животных II группы (контроль основы), до десятых суток эксперимента определялся отек, лимфогистиоцитарная инфильтрация и дегенеративно-дистрофические изменения подкожной клетчатки, мышечного слоя (рис. 76).
Рисунок 76. Группа II (контроль основы). Десятые сутки эксперимента. Окраска – гематоксилин Майера и эозин. УвХ 20
В группе III (традиционное лечение) к 25 суткам сохранялись дегенеративно-дистрофические изменения подкожной клетчатки и мышц, дегенеративные изменения нервных стволиков (рис. 77).
Рисунок 77. Группа III (традиционное лечение). 25 сутки. Дегенеративные изменения нервных стволиков. Окраска – гематоксилин Майера и эозин. Увеличение 40.
Гистологический контроль показал, что формирование грануляционной ткани происходит от краев дефекта к центру раны, поэтому она имеет очаговое расположение и отличается полиморфизмом клеточных элементов, среди которых встречаются нейтрофильные лейкоциты, макрофаги и гистиоциты. Основу грануляционной ткани составляют единичные вертикально расположенные капилляры, имеющие различный диаметр, стенка которых состоит из одного ряда эндотелиальных клеток. Встречаются единичные фибробласты, которые в глубоких слоях раны принимают перпендикулярное по отношению к сосудам положение. Малодифференцированные фибробласты имеют типичное строение: веретеновидную форму и крупное ядро с небольшим объемом цитоплазмы. Ориентированы в различных направлениях в грануляционной ткани и не образуют скоплений. Сама ткань выглядит отечной, отчетливо выражена лейкоцитарная инфильтрация не только в поверхностных слоях, но и в области дна. Одновременно с формированием новообразованной ткани начинается эпителизация раны, степень которой тесно связана с ее гранулированием. Регенерация эпителия характеризуется тремя процессами: миграцией клеток, их пролиферацией и последующей дифференцировкой. Растущий эпителий имеет вид клина, истонченного в сторону центра раны, со слабо выраженной гипертрофией на границе с неповрежденной кожей. Очаговый характер молодой ткани и ограниченная площадь определяют и незначительную протяженность регенерирующего эпителия.
У животных экспериментальной группы I, течение посттравматической репарации было более благоприятным, что находило отражение в морфологическом строении всех структур полнослойного дефекта. Струп был неоднороден, образован только клеточным детритом и не содержал участков, заполненных плазмой. Лейкоцитарный вал содержал находящиеся на стадии физиологической дегенерации нейтрофилы. Грануляционная ткань животных имела очаговый характер, но занимала большую площадь. Новообразованная ткань характеризовалась мощным развитием кровеносных сосудов и пролиферацией фибробластов. Клеточные элементы фибробластического ряда были представлены крупными вытянутыми многоотростчатыми клетками, что свидетельствовало об их высокой функциональной активности. Они были ориентированы параллельно поверхности раны, что особенно было выражено в периферических участках и глубоких слоях раневого дефекта. В составе межклеточного вещества увеличивалось количество коллагеновых волокон, которые агрегировались в пучки.
Таким образом, при применении действующего вещества ксеногенного происхождения (Группа I) отмечалось выгодное от остальных групп животных равномерное формирование соединительной ткани по всему дефекту. Эпителизация проходила успешно – эпидермис имел все признаки дифференцировки, дистрофически не изменился. Подкожная жировая клетчатка в воспалительные процессы не была вовлечена. Реструктуризация дермы происходила с нарастанием пула грануляций, стимуляцией миграции и пролиферации фибробластов, кератиноцитов, эндотелиальных и других клеток, что способствовало восстановлению ткани, сокращению времени репарации и отсутствию осложнений.
Иммуногистохимическое исследование проводили в парафиновых срезах с использованием соответствующих первичных антител и системы визуализации En vision. Ядра докрашивали гематоксилином. Тепловое демаскирование антигенов проводили в микроволновой печи. Анализ проводили с помощью микроскопа Olympus CX41 и цифровой камеры CDх41 со встроенным программным обеспечением.
Пролиферативную активность клеток эпидермиса и дермы изучали с помощью моноклональных антител Ki67 (MIB-1), идентифицирующих ядерный антиген, присутствующий у большинства пролиферативных клеток. Антиген Ki67, определяемый соответствующими моноклональными антителами – короткоживущий протеин, разрушающийся на протяжении 1–1,5 часа, благодаря этому он выявляется только в клетках, которые делятся. Для оценки процессов апоптоза использовали моноклональные антитела к Fas-рецепторам (CD95/Apo 1).
В процессе заживления ран на этапе гнойно-некротической фазы преобладающей формой клеток был нейтрофильный клеточный пул, что обеспечивало активное противостояние бактериальной флоры и иммунной системы. Для перепроверки этих фактов идентифицировались клетки, экспрессирующие на мембране рецептор СD4+. Общее количество клеток данной субпопуляции снижается по сравнению с клетками здоровой кожи (9,33±0,26 и 13,85±0,19 соответственно).
Известно, что рецепторы СD4 присутствуют преимущественно на Т-лимфоцитах и, будучи комплементарными HLA-антигенам II класса, обеспечивают контакт Т-клеток с макрофагально-гистиоцитарным микроокружением. В процессе заживления раны наблюдалось периваскулярное разрежение Т-клеток по сравнению с нормальной здоровой кожей.
Также уменьшалось количество антиген представляющих клеток Лангерганса СD68+ (25,7±0,29 и 34,0±0,32 соответственно), а следовательно, и их способность вступать в межклеточные взаимодействия при реализации адаптивного иммунного ответа. Снижалась миграционная активность клеток СD68+, на их поверхности уменьшалось число молекул адгезии, продуктов генов главного комплекса гистосовместимости II класса и костимулирующих молекул.
Нарушение хода физиологической регенерации и появление участков гипертрофии связано с нарушением функции антигенпрезентации клеток Лангерганса, их расположением в подлежащей эпителию соединительной ткани на фоне снижения количеств, что может свидетельствовать о нарушении антигенпредставления в структурах кожи человека и последующем снижении контроля за физиологической и репаративной регенерацией в целом, запуске процесса адаптивной гипертрофии в структурах кожи для сохранения барьерных свойств эпителия. Наблюдалось снижение пула тучных клеток СD204+ (2,17±0,2 и 4,0±0,18 соответственно), а также их дегрануляция. Численность моноцитов кожи СD14+ достоверно увеличивалась: 11,5±1,4 в ране и 4,34±0,49 в контроле.
В зоне раны и подлежащей верхним слоям соединительной ткани визуализировались активированные макрофаги, характеризующиеся экспрессией СD163+, и фибробласты, отвечающие за реструктуризацию кожного покрова. Для обеспечения максимальной защиты раны от внешних воздействий и полноценной регенерации появляются СD8+-лимфоциты, продуцирущие те же цитокины, что и СD4+-Th1 (TNF-α и TNF-β, IL-2,3, IFN-γ, ГМ-КСФ). Это наблюдение устанавливает роль клеток кожи в процессе репаративной регенерации в условиях гнойно-инфицированной раны. В частности, выявлено угнетение T-клеточного звена, снижение количества клеток Лангерганса и тучных клеток кожи в фазу воспаления, что приводит к извращению антигенпрезентации и нарушению в дальнейшем иммунных клеточных взаимодействий, а также нормального хода регенерации эпидермиса и дермы.
Кроме того, в экспериментальной группе I при применении действующего вещества на 1–3 сутки эксперимента наблюдался рост носителей CD95+ с последующим его снижением, начиная с 3–5 суток. С первых суток наблюдался рост носителей маркера Ki67+ и продолжался до 15 суток эксперимента. На 3–5 сутки возникает «перекрест маркеров», что характеризует переход первой фазы раневого процесса во вторую: завершение процессов гибели клеток и начало активных пролиферативных процессов. В группе контроля традиционного лечения наблюдалось снижение уровня маркера готовности клеток к апоптозу. На пятые сутки эксперимента отмечался всплеск уровня маркера пролиферации с дальнейшим его снижением практически до нуля. В эпидермисе рубцов обнаруживались активные процессы пролиферации. Метка локализовалась в ядрах клеток базального и шиповатого слоя. В дерме метка присутствовала в округлых клетках. Они имеются в сосудах и между коллагеновыми волокнами зоны роста. Возможно, это клетки фибробластического ряда. Экспрессия белка Fas, свидетельствующая о том, что эпидермоциты готовы к апоптозу, была обнаружена в клетках базального и шиповатого слоя. В дерме метки не наблюдалось.
Значительное (в пять раз) ускорение очищения раны в первую фазу раневого процесса в экспериментальной группе I по сравнению с группами контроля, а также эпителизация раны без образования соединительнотканного рубца с восстановлением функции поврежденного участка (рост волосяного покрова) связаны с индуцирующим влиянием действующего вещества ксеногенного происхождения на способ гибели клеток в первую фазу раневого процесса и характеризуют потенцирование механизмов репаративной регенерации. Это подтверждается и данными, полученными при иммуногистохимическом исследовании. До начала лечения количество клеток, экспрессирующих маркер CD95+ и маркер пролиферации – Ki67+, было одинаково высоко во всех экспериментальных группах. Динамика проапоптотического маркера CD95+ и маркера готовности клеток к пролиферации Ki67+ представлена в табл. 9 и 10.
Таблица 9. Динамика проапоптотического маркера CD95+
|
Срок эксперимента |
Группы животных |
|||
|
I |
II |
III |
IV |
|
|
До лечения |
5 % |
5 % |
7 % |
4 % |
|
1 сутки |
10 % |
4 % |
5 % |
5 % |
|
3 сутки |
8 % |
2 % |
5 % |
3 % |
|
5 сутки |
6 % |
0 % |
4 % |
1 % |
|
10 сутки |
5 % |
0 % |
3 % |
0 % |
|
15 сутки |
2,5 % |
0 % |
4 % |
0 % |
До начала лечения во всех группах выявлялся одинаковый уровень маркера CD95+. На первые сутки эксперимента в I группе уровень маркера CD95+ вырастал в два раза – 10 % – и оставался высоким до пяти суток (5–8 %).
Таблица 10. Динамика маркера готовности клеток к пролиферации Ki67+
|
Срок эксперимента |
Группы животных |
|||
|
I |
II |
III |
IV |
|
|
До лечения |
1 % |
1 % |
1 % |
1 % |
|
1 сутки |
2 % |
2 % |
3 % |
2 % |
|
3 сутки |
5 % |
2 % |
2 % |
1 % |
|
5 сутки |
7 % |
0 % |
6 % |
1 % |
|
10 сутки |
8 % |
0 % |
0,5 % |
0 % |
|
15 сутки |
10 % |
0 % |
1 % |
0 % |
Начиная с третьих суток в I (экспериментальной) группе нарастал уровень Ki67+ (4–5 %) и сохранил свои значения до 15 суток эксперимента (8–11 %). В группе II (контроль основы) наблюдался умеренный рост CD95+ и Ki67+, в группе III (традиционное лечение) на 3–5 сутки уровень маркеров не отличался от исходного.
До 15 суток эксперимента в экспериментальной группе I сохранялся высокий уровень Ki67+ (8–11 %), в группах контроля уровень CD95+ и Ki67+ стремился к нулю (0–4 %).
При этом, исследуя количество лимфоцитов с активированным CD95+, установили одинаковый уровень маркера во всех группах до начала лечения (рис. 78).
Рисунок 78. Уровень CD95+ инфицированных ран мягких тканей в группах сравнения до лечения
Также во всех группах наблюдался примерно одинаковый уровень маркера пролиферации – Ki67+ (рис. 79).
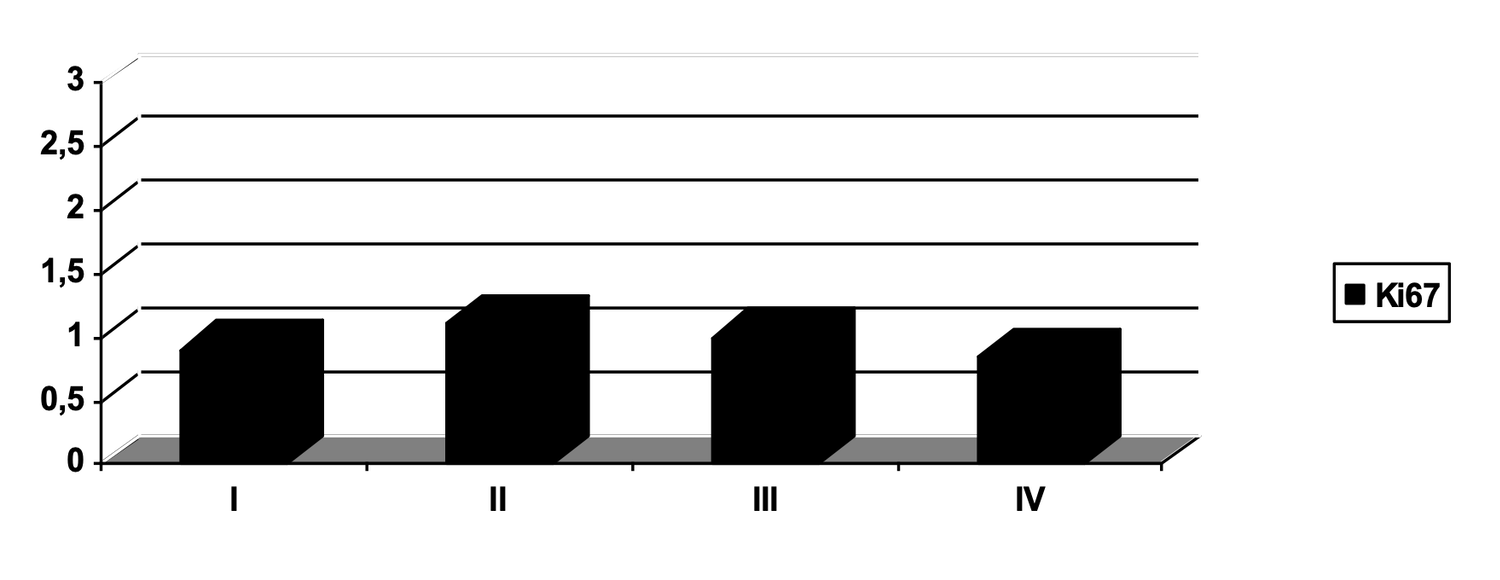
Рисунок 79. Уровень Ki67+ инфицированных ран мягких тканей в группах сравнения до лечения
В экспериментальной группе I при применении клеток-предшественниц на 1–3 сутки эксперимента наблюдался рост носителей CD95+ с последующим его снижением, начиная с 3–5 суток. С первых суток наблюдается рост носителей маркера Ki67+и продолжался до 15 суток эксперимента. На 3–5 сутки возникает «перекрест маркеров» (рис. 80), что характеризует переход первой фазы раневого процесса во вторую: завершение процессов гибели клеток и начало активных пролиферативных процессов.
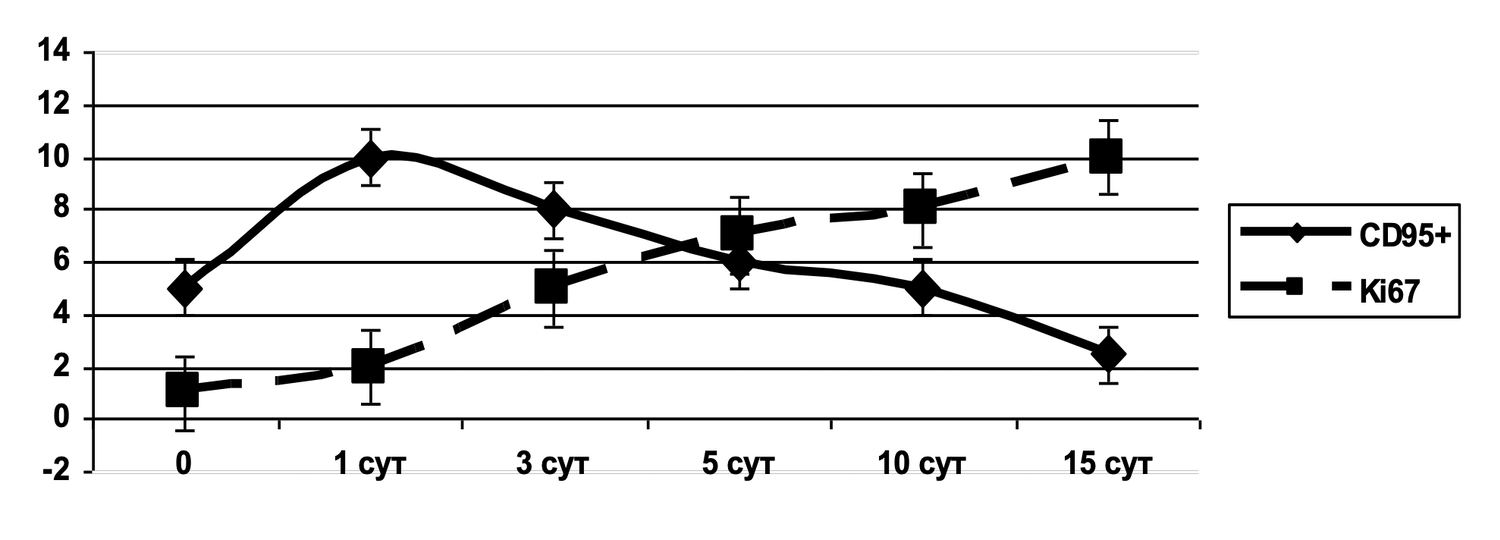
Рисунок 80. Группа I (экспериментальная). Динамика маркеров апоптоза и пролиферации в лечении инфицированной раны мягких тканей
В группе II (контроль основы) к 3–5 суткам наблюдался резкое падение как маркера готовности клеток к апоптозу, так и маркера пролиферации (рис. 81).
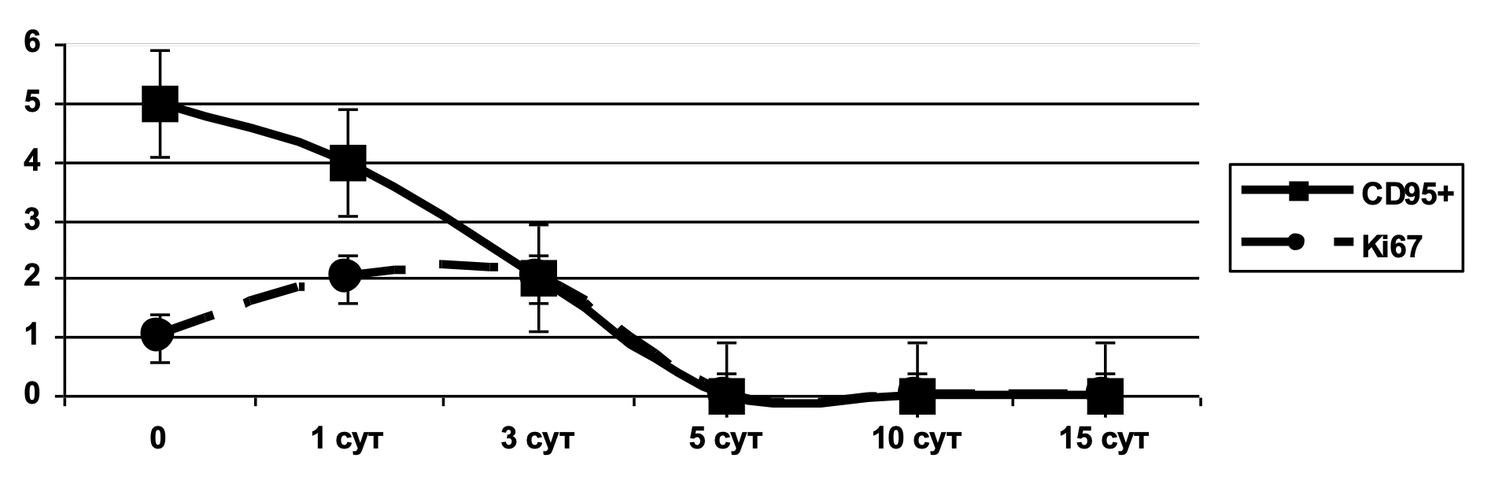
Рисунок 81. Группа II (контроль основы). Динамика маркеров апоптоза и пролиферации
В группе III (традиционное лечение) наблюдался снижение уровня маркера готовности клеток к апоптозу, на пятые сутки эксперимента отмечается некоторый всплеск уровня маркера пролиферации с дальнейшим его уменьшением практически до нуля (рис. 82).
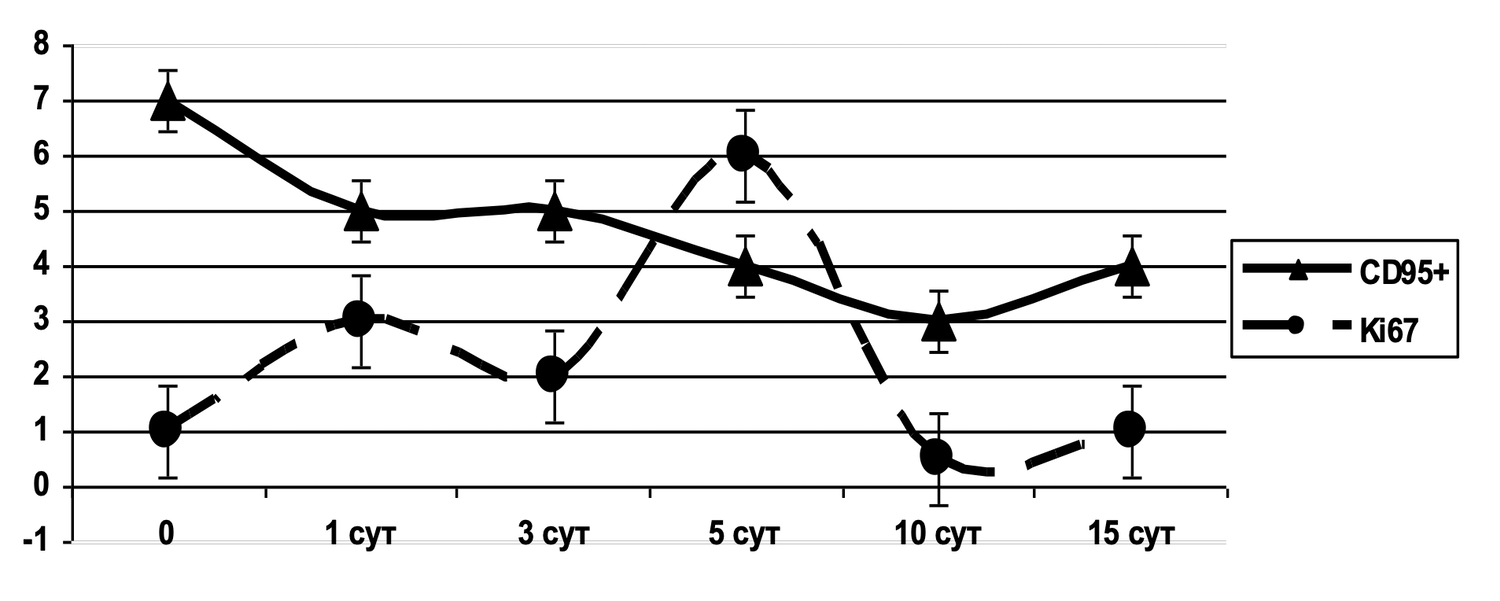
Рисунок 82. Группа III (традиционное лечение). Динамика маркеров апоптоза и пролиферации
В группе IV (без лечения) к 3–5 суткам наблюдался резкое падение как маркера готовности клеток к апоптозу, так и маркера пролиферации (рис. 83).
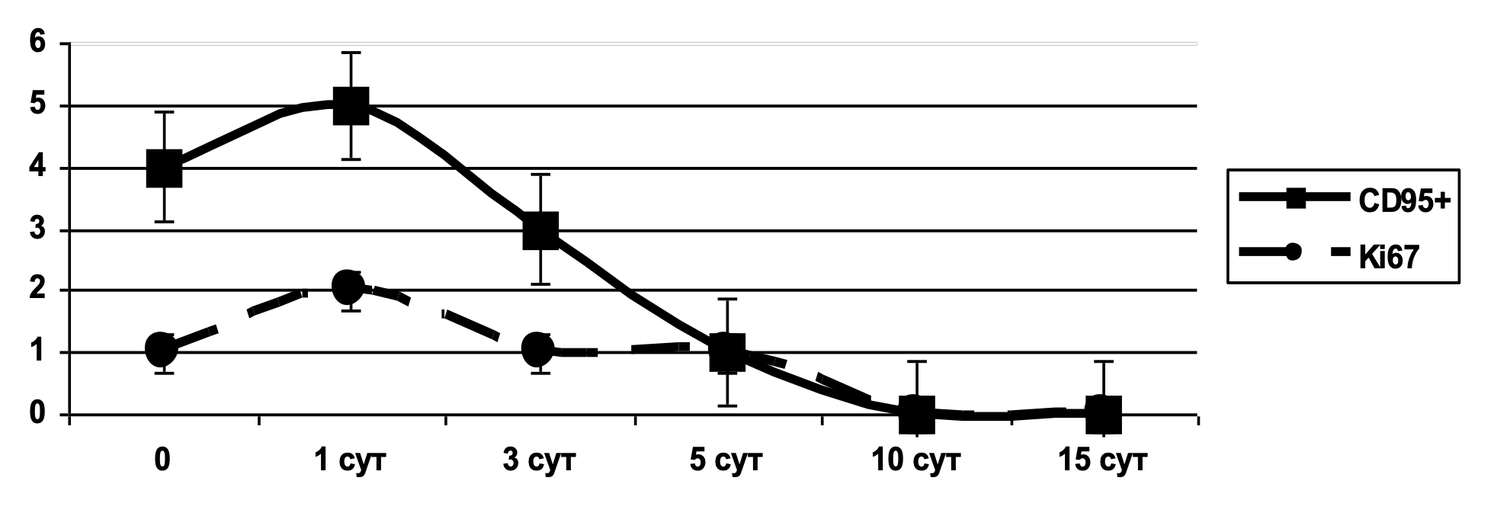
Рисунок 83. Группа IV (без лечения). Динамика маркеров апоптоза и пролиферации
Таким образом, исследуемое вещество является индуктором апоптоза в первую фазу раневого процесса. Во вторую и третью фазы раневого процесса данное вещество индуцирует механизмы репарации.
Дополнительно было установлено, что для получения отчетливого эффекта в составе клеточной суспензии – источнике молекул адгезии, должна содержаться определенная концентрация клеток фенотипа CD34+CD45dim. При попытке уменьшения концентрации клеток указанного фенотипа ниже 0,75×106/мл значительно снижался репарационный эффект. В свою очередь повышение концентрации выше 1,25×106/мл не приводило к существенному увеличению эффективности. Применение этих свойств в качестве индукторов апоптоза и пролиферации открывает новые перспективы регуляции раневого процесса. В том числе в инфицированных ранах.
Но, прежде чем приступить к клиническим испытаниям, необходимо провести доклинические исследования готового биотехнологического средства, представленного супернатантом клеток SPF-эмбриона курицы шестого дня гестации в концентрации 0,75×106 – 1,25×106 клеток фенотипа CD34+CD45dim в 1 мл гелеобразующего биополимера на основе гидроксиэтилцеллюлозы.
Содержание токсичных компонентов, оценка бактериальной обсемененности, изучение кожно-резорбтивного действия и антибактериальная активность были оценены в двух независимых лабораториях. Результаты испытаний методами атомно-абсорбционной спектрометрии «PinAAcle 900F» и «МГА-915М» с ртутно-гидридной приставкой РГТ-915 и газовой хроматографии с использованием приборов «GC 2010 Plus» и «Кристалл-2000 М» отражены в Протоколе лабораторных испытаний № 374 КХ Федерального агентства по техническому регулированию и метрологии ФБУ «Государственный региональный центр стандартизации, метрологии и испытаний в Москве и московской области» от 21.06.2021 (Приложение 5) и Протоколе лабораторных испытаний №62Л/З-31.01/23 от 31.01.2023 испытательной лаборатории «LIGHT GROUP» испытательного центра «CERTIFICATION GROUP» (Приложение 6).
В ходе испытаний, дополнительно оценивалась антибактериальная активность по методу «Определения чувствительности микробов к антибиотикам методом диффузии в агар с применением бумажных дисков» (рис. 84).
Рисунок 84. Оценка антибактериальной активности биотехнологического средства ксеногенного происхождения по методике «Определение чувствительности микробов к антибиотикам методом диффузии в агар с применением бумажных дисков» в отношении St. Aureus 155, E. Coli 2290, B. Cereus Jp 5832.
Были получены следующие результаты (табл. 11 – 13).
Таблица 11. Оценка антибактериальной активности антибиотиков широкого спектра действия биотехнологического средства в отношении E. Coli 2290, n=10
|
Исследуемые средства |
Диаметр зоны подавления (мм) |
|
«Канамицин» |
20,06 ± 0,7* |
|
«Карбенициллина динатриевая соль» |
15,8 ± 1,1* |
|
«Гентамицина сульфат» |
23,1 ± 1,9 |
|
«Рифампицин» |
15,6 ± 0,9* |
|
«Действующее вещество биотехнологического средства» |
26,8 ± 0,6 |
* наблюдаемые различия статистически значимы – p<0,05
Таблица 12. Оценка антибактериальной активности антибиотиков широкого спектра действия биотехнологического средства в отношении St. Aureus 155, n=10
|
Исследуемые средства |
Диаметр зоны подавления (мм) |
|
«Канамицин» |
18,3 ± 0,8* |
|
«Карбенициллина динатриевая соль» |
21,1 ± 0,5* |
|
«Действующее вещество биотехнологического средства» |
28,3 ± 1,1 |
* наблюдаемые различия статистически значимы – p < 0,05
Таблица 13. Оценка антибактериальной активности антибиотиков широкого спектра действия биотехнологического средства в отношении B. Cereus 5832, n=10
|
Исследуемые средства |
Диаметр зоны подавления (мм) |
|
«Гентамицина сульфат» |
23,1 ± 1,8* |
|
«Рифампицин» |
13,8 ± 0,6* |
|
«Действующее вещество биотехнологического средства» |
32,7 ± 2,1 |
* наблюдаемые различия статистически значимы – p<0,05
Отмечено, что диаметры зон подавления роста St. Aureus 155, E. Coli 2290 и B. Cereus Jp 5832 биотехнологического средства достоверно выше сравниваемых антибактериальных средств.
Таким образом, полученное авторским способом, биотехнологическое средство действуя как катализатор грануляционного роста, безопасно, стерильно, не токсично, запускает процессы пролиферации и дополнительно обладает бактериостатической активностью.
Учитывая, что процессы заживления подчиняются тем же законам, что и процессы пролиферации и апоптоза, и регулируются через клеточно-клеточные и клеточно-матриксные сигналы, а также данные о дозозависимом влиянии на жизнеспособность и процессы апоптоза клеток в культуре, было изобретено биотехнологическое средство для заживления ран различной этиологии Cellgel 114, в основе которого использован эффект активации клеток с фенотипом CD34+CD45dim кожи посредством избирательного воздействия молекул адгезии 115.
Перечисленные выше результаты независимых испытаний, стали основой дальнейших научных исследований 116 117 118 119, практического применения обнаруженных свойств. Контрактный выпуск разработанного средства организован, а его применение обусловлено декларациями Таможенного Союза о соответствии № ТС RU Д-RU.АЛ14.В.03012 от 25.12.2012 г. и № ЕАЭС RU Д-RU.РА01.В.56185/21 от 25.06.2021, что позволило использовать разработанное биотехнологическое средство в дерматологической практике для интенсификации репарации эрозивно-язвенных поражений кожи при иммуноопосредованных дерматозах и повреждениях кожи различной этиологии.
Пациент И., 52 года, поступил в стационар Тюменского областного кожно-венерологического диспансера с жалобами на интенсивный кожный зуд, покраснение, выраженную сухость кожи, расчесы, отек кожи в области сгибов крупных суставов с трещинами и обильным шелушением кожи туловища.
Из анамнеза известно, что первые симптомы поражения кожи появились в детском возрасте, диагноз нейродермит установлен сразу, протекал с обострениями 3 и более раз в год, в весенне-летний период. В последствии диагноз был изменен на атопический дерматит, проводилось лечение топическими ГКС, ингибиторами кальциневрина, антигистаминными препаратами, увлажняющими и смягчающими средствами. В последние 3 года заболевание рецидивирует чаще 4-х раз в год, сопровождается сильным зудом и вторичным инфицированием. Неоднократно получал лечение в стационаре ОКВД, в том числе преднизолон до 60 мг в/в и антибактериальная терапии инфекционных осложнений экскориаций. Эффект от терапии был удовлетворительный.
При поступлении состояние средней тяжести. Конституция гиперстеническая. Аллергологический анамнез и наследственность не отягощены. Живот мягкий, безболезненный при пальпации. Печень, селезенка не увеличены. Стул регулярный, без патологических примесей. Симптом поколачивания отрицательный с обеих сторон. Мочеиспускание безболезненное. Щитовидная железа визуально не увеличена, пальпация ее безболезненная. Лимфатические узлы пальпируются по задней поверхности шеи и в подмышечных областях, безболезненные, подвижные, мягкоэластичной консистенции. Носовое дыхание не затруднено. Над всей поверхности легких ясный легочный перкуторный звук. Дыхание везикулярное, хрипы не прослушиваются. ЧДД 18 в минуту. Тоны сердца ясные, ритмичные, ЧСС 74 в минуту, артериальное давление 130/80 мм рт. ст. Язык влажный, розовый. ЭКГ: ритм синусовый, ЧСС 78 в минуту. КТ-признаков очаговых и инфильтративных изменений в паренхиме легких не выявлено. УЗИ органов брюшной полости, забрюшинного пространства, щитовидной железы и паращитовидных желез патологии не выявило.
Патологический процесс носит распространенный характер. Представлен разлитой эритемой кожи туловища, конечностей, трещины в локтевых и подколенных сгибах, обильное лихеноидное шелушение с линейными следами расчесов по всей поверхности кожи без признаков пиодермии. В области розовой каймы губ проявления хейлита. Ногти на руках имеют полированный блеск. Индекс SCORAD – 84. Лабораторные и инструментальные исследования при поступлении. Клинические анализы крови и мочи в пределах нормы. Показатели биохимического анализа крови в пределах нормы. Гормоны щитовидной железы в пределах нормы. Иммуноглобулины А, М, G в сыворотке крови в пределах нормы. Уровень СРБ в крови – 8 мг/л. Общий IgЕ более 1000 МЕ/мл. Обследование на гельминтозы не выявило контаминации.
На основании жалоб, анамнеза заболевания, клинической картины и результатов обследования поставлен диагноз: атопический дерматит, распространенная форма, тяжелое течение, фаза выраженных клинических проявлений, осложненный травматическими экскориациями.
В стационаре проводилось лечение: метилпреднизолон 250 мг внутривенно в 200 мл физиологического раствора 7 дней, лоратадин 10 мг внутрь 7 дней, топическая терапия мометазоном. Эффект от проводимого лечения незначительный – зуд уменьшился, снизилась инфильтрация кожи в области локтевых сгибов и подколенных областей, но обилие экскориаций и трещин с мокнутием сохраняется. Это стало обоснованием для прецизионной диагностики путем оценки цитоиммунограммы кожи (табл. 14).
Таблица 14. Цитоиммунограмма кожи больного И., 52 года, от 28 июня 2015 года № 89/1
|
Субпопуляции клеток кожи и жизнеспособность |
Фенотип |
Показатели, % |
|
Кератиноциты, из них активированные |
CD49f+ CD49f+ HLA-DR+ |
57,2 31,6 |
|
Фибробласты, |
CD45– CD14– CD44+ CD45– CD14– CD44+ CD80+ |
52 6,7 |
|
Клетки Лангерганса, |
CD207+ CD207+ CD80– HLA-DR+ CD207+ CD80+ HLA-DR– CD207+ CD80+ HLA-DR+ |
49 19,9 26,0 3,1 |
|
Эндотелиальные клетки, из них активированные |
CD146+ CD146+ CD54– HLA-DR+ CD146+ CD54+ HLA-DR– CD146+ CD54+ HLA-DR+ CD146+ CD34+ |
13,9 4,2 9,5 0 0,2 |
|
Тучные клетки, из них активированные |
CD249+ CD249+ CD63+ |
6,6 2,9 |
|
Моноциты, из них активированные |
CD45+ CD14+ CD45+ CD14+ HLA-DR+ |
3,0 1,5 |
|
Эпидермальные лимфоциты Т-общие Т-хелперы Т-цитотоксические В-лимфоциты NK-клетки |
CD45+ CD3+ CD45+ CD3+ CD4+ CD8– CD45+ CD3+ CD4– CD8+ CD45+ CD3+ CD19+ CD45+ CD3– CD16+ CD56+ |
25 12 21 6 10 |
|
Жизнеспособность, % |
94 |
Общая жизнеспособность клеток – 94 %, что подтверждает корректность пробоподготовки. Иммунный фенотип демонстрирует высокоактивный воспалительный тип (Th2-доминантный профиль) с признаками выраженной антиген-презентации и вовлечением как эпидермальных, так и эндотелиальных компонентов воспаления. Фенотип соответствует остро-подострому периоду обострения атопического дерматита с активными проявлениями клеточного иммунного звена и нарушением барьерной функции кожи.
Анализ субпопуляций клеток представлен ниже.
Кератиноциты (CD49f+ HLA-DR+). Общая доля – 57,2 %, активированные – 31,6 %. Наблюдается резкая активация эпидермиса, подтверждающая повреждение барьерного слоя и усиленную экспрессию HLA-DR. Такая гиперактивация типична для атопического дерматита – кератиноциты становятся не только структурными, но и иммунокомпетентными элементами, продуцирующими цитокины IL-1, IL-33, TSLP, инициируя Th2-воспаление.
Фибробласты (CD45– CD14– CD44+ CD80+). Общее количество – 52 %, активированные – 6,7 %. Регистрируется умеренно высокая активность фибробластов – признак ремоделирования дермы и участия в воспалительно-репаративных процессах. Эта активация сочетается с гиперпродукцией цитокинов IL-6 и IL-8 и участием в формировании воспалительного инфильтрата.
Клетки Лангерганса (CD207+). Общее количество – 49 %, активированные фенотипы (CD80+ HLA-DR+/–) – около 50 % суммарно. Выраженная антиген-презентация и повышение CD80+ HLA-DR+ фенотипов указывают на активное вовлечение дендритных клеток в запуск Th2-ответа. Этот паттерн характерен для острой фазы атопического воспаления, где клетки Лангерганса формируют основной вектор иммунной дисрегуляции.
Эндотелиальные клетки (CD146+ CD54+ CD34+). Совокупная доля – 13,9 %, преобладают CD54+ HLA-DR– (9,5 %). Выраженная эндотелиальная активация (повышенный ICAM-1) обеспечивает миграцию лейкоцитов в очаг воспаления. Такой фенотип характеризует сосудистую гиперактивность и микроциркуляторную дисрегуляцию, типичную для острой экзематоидной реакции.
Тучные клетки (CD249+ CD63+). Общее количество – 6,6 %, активированные – 2,9 %. Мастоциты находятся в состоянии умеренной дегрануляции – присутствует высвобождение гистамина и триптазы, поддерживающих зуд и сосудистую реакцию. Их активация усиливает Th2-доминантное воспаление.
Моноциты (CD45+ CD14+ HLA-DR+). Доля – 3 %, активированные – 1,5 %. Фагоцитарное звено умеренно вовлечено, что свидетельствует о постоянном поддержании воспалительного фонового процесса без эффективного завершения.
Эпидермальные лимфоциты:
В структуре лимфоцитарного звена прослеживается умеренный Th2/Th1 баланс с доминированием цитотоксических Т-клеток и повышением NK-активности. Такая конфигурация типична для атопического дерматита с вовлечением врожденного иммунитета в ответ на повреждение эпидермального барьера.
Фенотип кожи пациента И. демонстрирует острое воспаление с высокой антиген-презентацией и сосудистой активацией в сочетании с частичной репарацией.
Основные маркеры:
Такой цитоиммунный профиль характеризует декомпенсированный воспалительный фенотип.
Цитоиммунограмма кожи пациента И. до лечения отражает высокоактивное воспалительное состояние с Th2-доминантным характером и повреждением эпидермального барьера.
Ключевые механизмы следующие:
Фенотип соответствует «острому воспалительному типу» и является диагностически значимым ориентиром для мониторинга эффекта терапии – в частности, при сопоставлении с повторной ЦИГК после лечения.
Поскольку был обнаружен репаративный потенциал эндотелиальных клеток (их присутствие, но без должной активности к репарации), что подтверждается значениями CD146+ и CD146+CD34+ соответственно, с целью профилактики вторичного инфицирования эрозивных поражений кожи и скорейшей эпителизации, к общей топической терапии мометазоном было добавлено биотехнологическое средство Cellgel на эрозивные поражения кожи и трещины 2 раза в день, 10 дней.
Была отмечена положительная динамика кожного процесса: на фоне общего уменьшения площади поражения кожи и значительного снижения выраженности лихенификации кожи, отмечен регресс вторичных элементов (эрозии и чешуе-корки). Нежелательных эффектов отмечено не было. По мнению больного, такого «комфортного состояния кожи» он не отмечал более 10 лет (рис. 85).
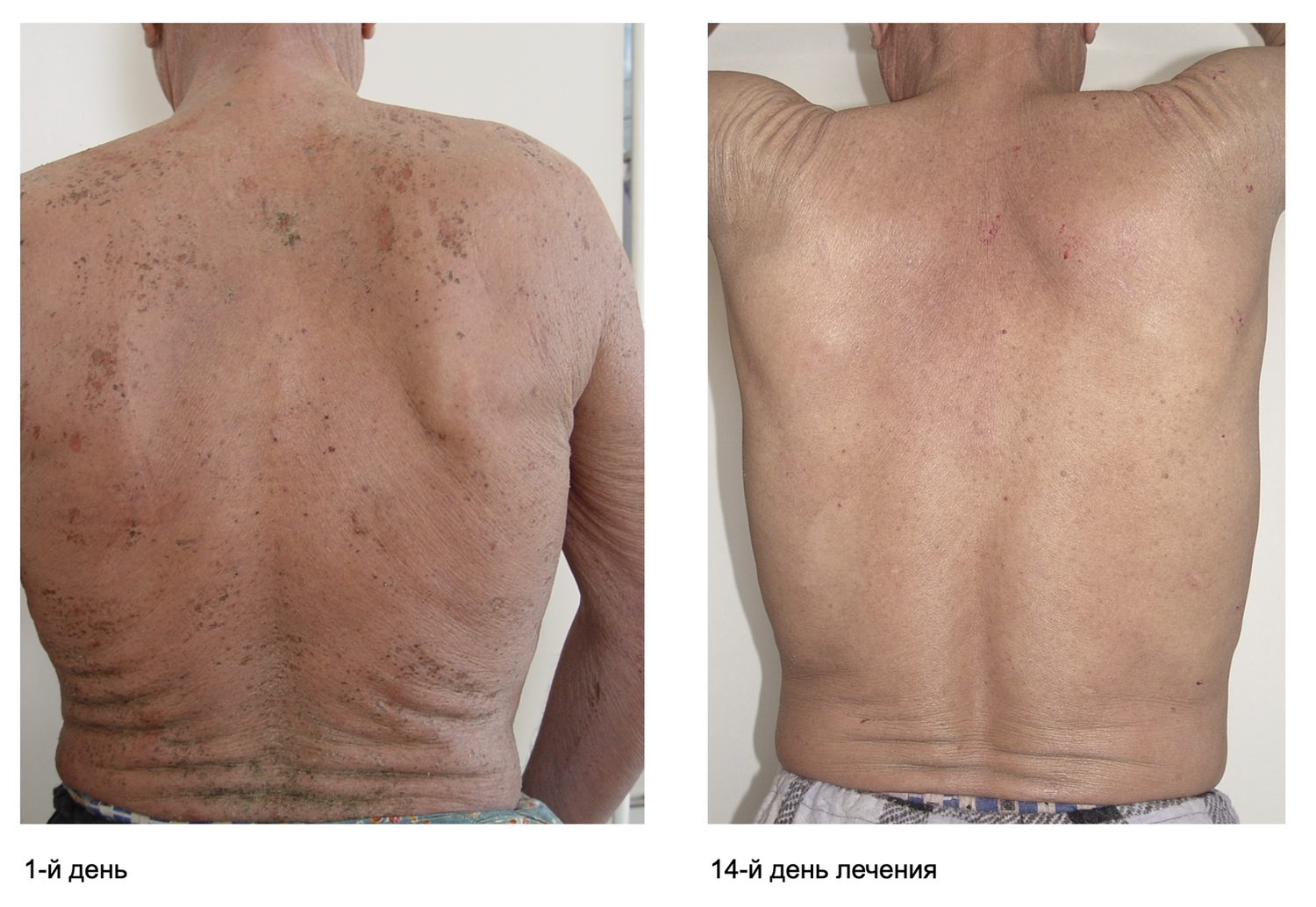
Рисунок 85. Клиническая демонстрация эффективности топической терапии эрозивных поражений кожи у больного И., 52 года, от 28 июня 2015 года № 89/1 и 9 июля 2015 года № 89/2
Одновременно с клинической эффективностью, проявленной снижением индекса SCORAD с 84 баллов до 22, было обнаружено снижение количества клеток в пробе, отвечающих за развитие воспалительного процесса и увеличение количества активированных эндотелиальных клеток в очаге воспаления – CD146+CD34+ – 0,2% до лечения и 8,9% после (табл. 15).
Таблица 15. Цитоиммунограмма кожи больного И., 52 года, от 9 июля 2015 года № 89/2
|
Субпопуляции клеток кожи и жизнеспособность |
Фенотип |
Показатели, % |
|
Кератиноциты, из них активированные |
CD49f+ CD49f+ HLA-DR+ |
54,1 24,3 |
|
Фибробласты, |
CD45– CD14– CD44+ CD45– CD14– CD44+ CD80+ |
48 2,7 |
|
Клетки Лангерганса, |
CD207+ CD207+ CD80– HLA-DR+ CD207+ CD80+ HLA-DR– CD207+ CD80+ HLA-DR+ |
39 14,3 16,0 8,7 |
|
Эндотелиальные клетки, из них активированные |
CD146+ CD146+ CD54– HLA-DR+ CD146+ CD54+ HLA-DR– CD146+ CD54+ HLA-DR+ CD146+ CD34+ |
25,4 5,2 11,3 0 8,9 |
|
Тучные клетки, из них активированные |
CD249+ CD249+ CD63+ |
2,6 0,9 |
|
Моноциты, из них активированные |
CD45+ CD14+ CD45+ CD14+ HLA-DR+ |
2,0 0,5 |
|
Эпидермальные лимфоциты Т-общие Т-хелперы Т-цитотоксические В-лимфоциты NK-клетки |
CD45+ CD3+ CD45+ CD3+ CD4+ CD8– CD45+ CD3+ CD4– CD8+ CD45+ CD3+ CD19+ CD45+ CD3– CD16+ CD56+ |
15 9 11 8 8 |
|
Жизнеспособность, % |
95 |
Общая жизнеспособность клеток – 95 %, что указывает на хорошее восстановление тканевого гомеостаза после лечения. Иммунный профиль демонстрирует снижение выраженности воспалительного фенотипа и переход от остро-доминантного Th2-воспалительного типа к сбалансированному репаративно-гомеостатическому.
По сравнению с исходной ЦИГК отмечается уменьшение активации антигенпрезентирующих клеток, нормализация сосудистого компонента и рост активности фибробластов, свидетельствующие о восстановлении барьерной и структурной функции кожи.
Анализ субпопуляций клеток дан ниже.
Кератиноциты (CD49f+ HLA-DR+). Общее количество – 54,1 %, активированных – 24,3 %. После лечения наблюдается уменьшение числа активированных кератиноцитов (ранее – 31,6 %), что отражает восстановление барьерной функции и ослабление цитокин-индуцированной экспрессии HLA-DR. Эпидермис сохраняет регенераторный потенциал без признаков гиперреактивности.
Фибробласты (CD45– CD14– CD44+ CD80+). Общая доля – 48 %, активированных – 2,7 %. Количество фибробластов немного снизилось (с 52 %), однако активированные формы уменьшились более чем в два раза (с 6,7 %), что отражает завершение активной репаративной фазы и переход к стабилизации матрикса дермы.
Клетки Лангерганса (CD207+). Общая доля – 39 %, активированные (CD80+ HLA-DR+/–) – около 39 % суммарно, что значительно ниже, чем до лечения (почти 50 %). Наблюдается снижение антигенпрезентационной активности, свидетельствующее о затухании иммунного возбуждения и снижении миграции дендритных клеток в эпидермис.
Эндотелиальные клетки (CD146+ CD54+ CD34+). Совокупная доля – 25,4 %, что выше нормы, однако со смещением в пользу CD34+ (8,9 %) – маркера неоангиогенеза и восстановления микрососудистого русла. Активированные формы (CD54+ HLA-DR+/–) снижаются (до ~16 %), что указывает на уменьшение сосудистой гиперактивности и переключение с воспалительной на регенераторную эндотелиальную реакцию.
Тучные клетки (CD249+ CD63+). Общее количество – 2,6 %, активированные – 0,9 %. Отмечается снижение дегрануляции мастоцитов (до 1/3 от исходного уровня), что подтверждает угасание острого зуда и вазореакции.
Моноциты (CD45+ CD14+ HLA-DR+). Доля – 2 %, активированные – 0,5 %. Фагоцитарное звено приходит к базальной активности, что соответствует разрешению воспалительного процесса.
Эпидермальные лимфоциты:
Лимфоцитарный баланс восстанавливается: снижается доля CD4+ клеток (Th2-компонент) и нормализуется соотношение CD4/CD8 ≈ 0,8 (до лечения ≈ 0,6). Это отражает переход иммунного ответа из Th2-доминантного состояния в сбалансированное Th1/Th2 и завершение воспалительной реакции.
После терапии цитоиммунограмма демонстрирует восстановление клеточного гомеостаза и редукцию воспалительного каскада.
Основные фенотипические признаки:
Фенотип кожи можно отнести к типу «восстанавливающий, поствоспалительный», что соответствует состоянию клинической ремиссии атопического дерматита.
Цитоиммунограмма кожи пациента И. после лечения показывает следующее:
Это подтверждает эффективность терапии кожных заболеваний.
Таким образом, было установлено, что между составляющими компонентами разработанного биотехнологического средства «Cellgel» и данными прецизионной диагностики воспалительного инфильтрата у больного атопическим дерматитом существует тесная иммунопатогенетическая связь, что обеспечивает репаративное действие и обуславливает высокую эффективность средства в качестве дополнения к топической терапии.
Сравнительный анализ цитоиммунограмм кожи до и после курса терапии демонстрирует выраженные признаки снижения воспалительной активности и восстановления клеточного гомеостаза кожи, что указывает на успешность лечения и переход заболевания из фазы обострения в фазу ремиссии.
Эпидермальный уровень (кератиноциты и клетки Лангерганса). До лечения эпидермис характеризовался высокой активацией кератиноцитов (HLA-DR+ 31,6 %) и гиперфункцией клеток Лангерганса (CD80+ ≈ 50 %), что отражало нарушение барьерной функции и мощный Th2-опосредованный воспалительный ответ. После терапии доля активированных кератиноцитов снизилась до 24,3 %, а антигенпрезентирующих клеток – до ≈ 39 %, что указывает на восстановление барьерной целостности кожи и снижение антигенной стимуляции. Таким образом, эпидермис переходит из состояния хронической иммунной активации в состояние функциональной нормализации с сохранением базального метаболизма.
Дерма и сосудистое микроокружение (фибробласты, эндотелий, тучные клетки). После лечения отмечается уменьшение доли активированных фибробластов (с 6,7 % до 2,7 %) при сохранении их общего количества. Это отражает завершение репаративной фазы и переход к структурной стабилизации соединительнотканного матрикса. Эндотелиальные клетки демонстрируют качественный сдвиг: хотя их общая доля увеличивается до 25,4 %, структура фенотипа изменяется – снижается экспрессия ICAM-1 (CD54+ HLA-DR+/–) и возрастает представительство CD34+ клеток (8,9 %), что интерпретируется как переход от воспалительной активации к ангиорепарации. То есть сосудистое русло перестает поддерживать воспаление и начинает восстанавливаться. Количество тучных клеток и их активированных форм также значительно снижается (с 2,9 % до 0,9 %), что клинически соответствует ослаблению зуда и сосудистой гиперреактивности.
Иммунное звено (моноциты и лимфоциты). Активированные моноциты (CD14+ HLA-DR+) уменьшаются почти в три раза (с 1,5 % до 0,5 %), что говорит об угасании локальной фагоцитарной активности и снижении воспалительного потенциала кожи. Лимфоцитарный профиль демонстрирует нормализацию соотношения CD4+/CD8+, которое изменилось с 0,6 до 0,8. Это указывает на балансировку Th1/Th2-оси и снижение Th2-доминантности – ключевого механизма атопического воспаления. B-лимфоциты и NK-клетки сохраняют стабильные показатели, что свидетельствует о физиологическом тонусе врожденного иммунитета без его гиперактивации.
Говоря языком фенотипической дерматологии, данный случай демонстрирует смену ведущего паттерна фенотипа кожи: от дисбалансированного Th2-воспалительного с гиперактивацией антигенпрезентирующих клеток, эндотелиальной дисфункцией и дегрануляцией мастоцитов к структурно сбалансированному, где сохраняется минимальный уровень клеточной активности, направленный на поддержание барьерной целостности и ангиорепарации.
Таким образом, кожа переходит из состояния хронического иммунного возбуждения в фазу функциональной стабильности с восстановлением гомеостатического фенотипа, что подтверждает эффективность терапии и демонстрирует диагностическую ценность метода цитоиммунограммы кожи для мониторинга динамики заболевания.
Положительный результат от применения биотехнологического средства делает перспективным дальнейшее его использование у пациентов с тяжелым течением атопического дерматита, сопровождающегося эрозивными осложнениями и экскориациями.
С целью оптимизации топической терапии, проведено экспериментальное определение наличия или отсутствия репаративного действия разработанного биотехнологического средства на эрозивно-язвенные поражения кожи больных вульгарной пузырчаткой. Для этого, автором был получен патент РФ на изобретение № 2481115 от 23.03.2012.
Больная Я., 55 лет, обратилась в Тюменский областной кожно-венерологический диспансер в декабре 2018 г. с жалобами на распространенные симметричные высыпания на коже туловища и конечностей. Со слов больной, заболела остро, летом этого года. После появления первых признаков заболевания – единичных красных пятен на туловище, сопровождавшихся умеренным зудом, обратилась к дерматологу по месту жительства. Был поставлен диагноз «Дерматит?» и назначена симптоматическая терапия комбинированным ГКС. Спустя несколько дней, на фоне пятен стали появляться пузырьки. При обращении в ОКВД была госпитализирована для уточнения диагноза. История жизни, наследственный и аллергоанамнез без особенностей.
При поступлении, патологический процесс носил распространенный характер, локализуясь на коже туловища, верхних и нижних конечностей, был представлен множественными округлыми, местами отечными эритематозно-сквамозными очагами розового и светло-розового цвета и пятнами гиперпигментации коричневого цвета. На поверхности отдельных очагов поражения, преимущественно в области груди, спины, поясничной области, имелись сгруппированные пузырьки с серозным содержимым на гиперемированном фоне. На коже боковых поверхностей туловища, ягодиц и верхней трети плеч определялись овальные и круглые, сливающиеся между собой эрозии до 1 см в диаметре с корочками и чешуйками на поверхности пораженных участков кожи. Феномен Никольского был положительным. Придатки кожи и слизистые оболочки в процесс не были вовлечены.
Клинический диагноз при поступлении: Пузырчатка обыкновенная? Пузырчатка листовидная? Герпетиформный дерматит Дюринга?
Учитывая тяжелое состояние, стремительность развития пузырьковых и эрозивных элементов, возраст больной и положительный симптом Никольского была проведена диагностическая биопсия с кожи спины с гистологическим исследованием. По результатам гистологического исследования были выявлены изменения, которые потребовали дополнительных диагностических мероприятий. А именно: «эпидермис неравномерен с выраженным гиперкератозом и спонгиозом, клетки зернистого слоя разобщены между собой с тенденцией к образованию пузыря, в сосочковом слое дермы отек и диффузная лимфоцитарная инфильтрация с эозинофилами». Для уточнения диагноза было рекомендовано проведение РИФ и получение цитоиммунограммы.
По результатам комплексного клинико-лабораторного обследования выявлено положительный мазок-отпечаток на акантолитические клетки, лейкоцитоз (12,8*109/л) периферической крови, лимфопения (1,9 тыс/мкл), повышен уровень АЛТ составил 72 Ед/л, по результатам проведения нРИФ с антителами к IgG, IgA, IgM в биоптате видимо непораженной кожи наблюдалась умеренная фиксация IgG в межклеточных промежутках эпидермиса с понижением градиента фиксации от зернистого и рогового слоев к базальному.
Дополнительные сведения, полученные путем оценки цитоиммунограммы кожи, показали наличие репаративного потенциала в очагах воспаления (табл. 16).
Таблица 16. Цитоиммунограмма кожи больной Я., 55 лет, от 12 декабря 2017 года № 111/2
|
Субпопуляции клеток кожи и жизнеспособность |
Фенотип |
Показатели, % |
|
Кератиноциты, из них активированные |
CD49f+ CD49f+ HLA-DR+ |
41,2 26,2 |
|
Фибробласты, |
CD45– CD14– CD44+ CD45– CD14– CD44+ CD80+ |
31,0 2,9 |
|
Клетки Лангерганса, |
CD207+ CD207+ CD80– HLA-DR+ CD207+ CD80+ HLA-DR– CD207+ CD80+ HLA-DR+ |
54 22,0 19,0 3,0 |
|
Эндотелиальные клетки, из них активированные |
CD146+ CD146+ CD54– HLA-DR+ CD146+ CD54+ HLA-DR– CD146+ CD54+ HLA-DR+ CD146+ CD34+ |
15,1 3,2 7,5 3,3 1,1 |
|
Тучные клетки, из них активированные |
CD249+ CD249+ CD63+ |
13,1 1,9 |
|
Моноциты, из них активированные |
CD45+ CD14+ CD45+ CD14+ HLA-DR+ |
2,0 0,5 |
|
Эпидермальные лимфоциты Т-общие Т-хелперы Т-цитотоксические В-лимфоциты NK-клетки |
CD45+ CD3+ CD45+ CD3+ CD4+ CD8– CD45+ CD3+ CD4– CD8+ CD45+ CD3+ CD19+ CD45+ CD3– CD16+ CD56+ |
29 11 17 0 1 |
|
Жизнеспособность, % |
96 |
Общая жизнеспособность клеток – 96 %, что указывает на удовлетворительное качество биопсийного материала при выраженных деструктивно-воспалительных изменениях кожи. Картина отражает выраженный воспалительный и аутоиммунный процесс с активацией антигенпредставляющих и эпидермальных клеток, типичных для пузырчатки. Иммунный профиль демонстрирует тяжелый аутоиммунный воспалительный фенотип, характеризующийся гиперактивацией кератиноцитов, дендритных и эндотелиальных клеток, массивной антиген-презентацией и повышением цитотоксического звена. Фенотип соответствует декомпенсированному аутоиммунному типу воспаления с выраженным дисбалансом между презентацией антигенов, разрушением тканевых связей и нарушением барьерной функции кожи.
Представим анализ субпопуляций клеток.
Кератиноциты (CD49f+) – 41,2 %, из них активированных (CD49f+ HLA-DR+) – 26,2 %. Высокая доля HLA-DR+ отражает антигенпрезентирующую активность кератиноцитов, вовлеченных в аутоиммунный процесс и усиление аутоагрессивной реакции. Такой профиль характерен для пузырчатки вульгарной: активация кератиноцитов сопровождается продукцией аутоантигенов (десмоглеинов 1 и 3), что приводит к утрате десмосомальных связей и формированию внутрикожных пузырей.
Фибробласты (CD45– CD14– CD44+) – 31 %, активированных (CD44+ CD80+) – 2,9 %. Снижение активации соединительнотканных клеток по сравнению с кератиноцитами, что характерно для реакции дермы на повреждение. При этом активированные формы участвуют в выработке TGF-β и IL-6, поддерживающих воспалительный каскад и ангиогенез.
Клетки Лангерганса (CD207+). Общее количество – 54 %, активированные фенотипы (CD80+ HLA-DR+/–) – около 45 %. Это свидетельствует о чрезмерной антиген-презентации и миграции дендритных клеток в направлении базального слоя, где локализуется аутоиммунное повреждение. Такой уровень активации – характерный признак пузырчатки, где дендритные клетки формируют тесные контакты с Т-лимфоцитами, индуцируя продукцию аутоантител. Явное преобладание активированных форм (более 40 % от всех клеток) подтверждает интенсивную презентацию аутоантигенов в очагах поражения.
Эндотелиальные клетки (CD146+ CD54+ CD34+). Всего – 15,1 %, активированные – 3,2 %; CD54+ HLA-DR– – 7,5 %; CD54+ HLA-DR+ – 3,3 %; CD34+ – 1,1 %. Наблюдается эндотелиальная активация и выраженная сосудистая проницаемость, обеспечивающая экссудацию плазмы в очаги пузырей. Рост CD34+ клеток (~5 %) свидетельствует о компенсаторной попытке неоангиогенеза в ответ на воспалительно-деструктивные процессы.
Тучные клетки (CD249+ CD63+). Общее содержание – 13,1 %, активированных (CD63+) – 1,9 %. Присутствует слабая дегрануляция, характерная для хронической стадии аутоиммунного процесса.
Моноциты (CD45+ CD14+ HLA-DR+). Всего – 2 %, активированных (HLA-DR+) – 0,5 %. Низкий уровень, вероятно, вследствие миграции моноцитов в очаг воспаления и их дифференцировки в макрофаги.
Эпидермальные лимфоциты. Всего – 29 %, с распределением:
Преобладание CD8+ Т-клеток указывает на цитотоксический компонент аутоиммунного поражения кожи, при этом В-лимфоциты не детектируются в биоптате, что согласуется с их циркуляцией преимущественно в крови.
Цитоиммунограмма отражает активную фазу аутоиммунного воспаления, характерную для пузырчатки вульгарной. Превалирует активация эпидермальных клеток (кератиноцитов, клеток Лангерганса) и Т-цитотоксического звена. Умеренно вовлечены эндотелиальные и тучные клетки, тогда как моноцитарно-макрофагальный компонент снижен.
Фенотип указывает на дисбаланс между антигенпрезентирующими и регуляторными клетками, что подтверждает высокие значения фенотипического индекса воспаления кожи (ФИВК) до начала терапии.
Такой фенотип отражает неуправляемое воспаление с разрушением тканевой архитектуры и требует последующего фенотипического контроля эффективности иммуносупрессивной терапии.
В условиях стационара больной было проведено следующее лечение: таблетированный преднизолон из расчета 1 мг на кг массы тела в дозе 90 мг в сутки 30 дней, эссенциальные фосфолипиды по 5 мл в/в струйно, №5, «Панангин» по 1 табл. 3 раза 30 дней, «Кальций Д3» по 1 табл. 3 раза в сутки, наружная терапия мометазона фуроатом и раствором метиленового синего.
С целью скорейшей эпителизации эрозий и учитывая сведения цитоиммунограмм о наличии репаративного потенциала клеток кожи с фенотипом CD146+CD34+ – 1,1%, было рекомендовано применение биотехнологического средства Cellgel на эрозивные поражения кожи 2 раза в день, 30 дней.
На фоне терапии отмечалась выраженная положительная динамика в виде регресса большинства высыпаний с формированием пятен гиперпигментации. По результатам проведенного лечения больная была выписана с улучшением под наблюдение дерматолога по месту жительства в амбулаторных условиях и последующим решением вопроса о дальнейшем снижении суточной дозы принимаемого ГКС (рис. 86).
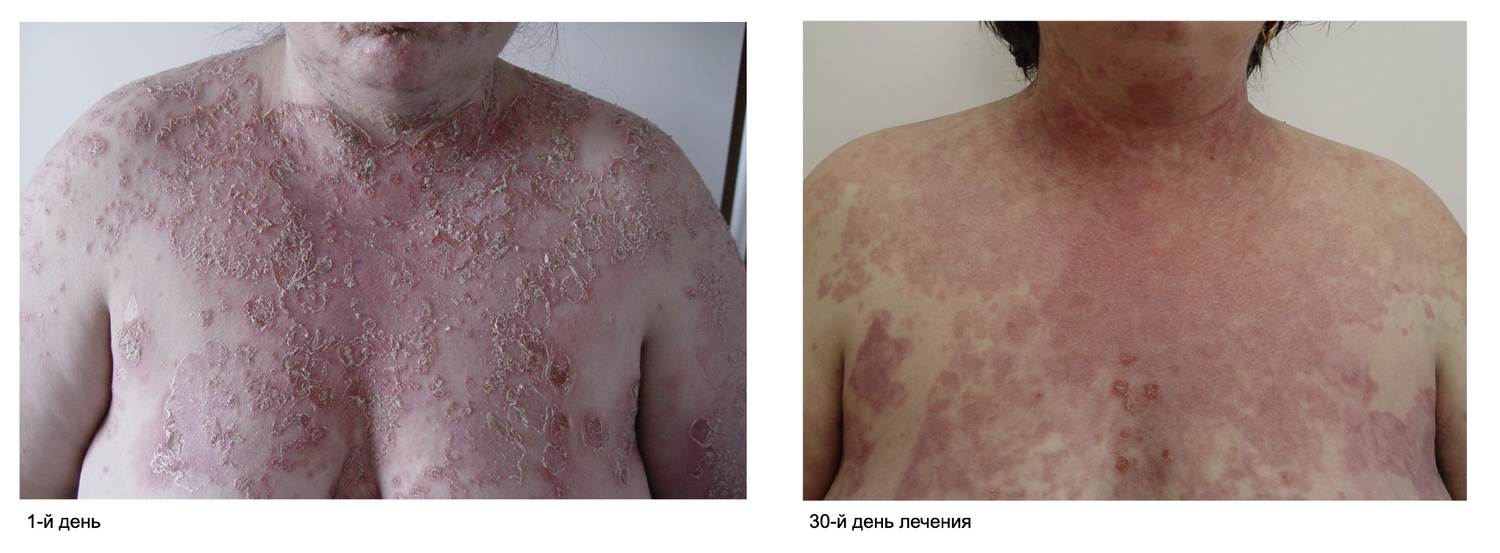
Рисунок 86. Клиническая демонстрация эффективности топической терапии эрозивных поражений кожи у больной Я., 55 лет, от 12 декабря 2017 года и 11 января 2018 года
При последующем наблюдении отмечалась стойкая клиническая ремиссия заболевания – новые высыпания не появлялись. Спустя два месяц после стационарного лечения суточная доза системного глюкокортикостероида была уменьшена с 60 мг в сутки на момент выписки, до 45 мг в сутки.
Было установлено (табл. 17), что между составляющими компонентами разработанного биотехнологического средства существует тесная иммунопатогенетическая связь, что обеспечивает сочетанное, синергичное пролиферативное и аниапоптотическое действие и обуславливает высокую эффективность средства в лечебном плане.
Таблица 17. Цитоиммунограмма кожи больной Я., 55 лет, от 14 февраля 2018 года № 111/3
|
Субпопуляции клеток кожи и жизнеспособность |
Фенотип |
Показатели, % |
|
Кератиноциты, из них активированные |
CD49f+ CD49f+ HLA-DR+ |
63,2 39,2 |
|
Фибробласты, |
CD45– CD14– CD44+ CD45– CD14– CD44+ CD80+ |
42,0 6,9 |
|
Клетки Лангерганса, |
CD207+ CD207+ CD80– HLA-DR+ CD207+ CD80+ HLA-DR– CD207+ CD80+ HLA-DR+ |
29 18,0 11,0 1,0 |
|
Эндотелиальные клетки, из них активированные |
CD146+ CD146+ CD54– HLA-DR+ CD146+ CD54+ HLA-DR– CD146+ CD54+ HLA-DR+ CD146+ CD34+ |
21,1 9,2 1,5 4,3 5,1 |
|
Тучные клетки, из них активированные |
CD249+ CD249+ CD63+ |
10,2 0,9 |
|
Моноциты, из них активированные |
CD45+ CD14+ CD45+ CD14+ HLA-DR+ |
2,0 1,5 |
|
Эпидермальные лимфоциты Т-общие Т-хелперы Т-цитотоксические В-лимфоциты NK-клетки |
CD45+ CD3+ CD45+ CD3+ CD4+ CD8– CD45+ CD3+ CD4– CD8+ CD45+ CD3+ CD19+ CD45+ CD3– CD16+ CD56+ |
34 23 10 0 0 |
|
Жизнеспособность, % |
98 |
Цитоиммунограмма до лечения (№ 111/2) отражала выраженное аутоиммунное воспаление с декомпенсацией барьерных и регуляторных механизмов: гиперактивация кератиноцитов, высокая антиген-презентация, сосудистая гиперреактивность, усиление цитотоксического звена. После проведенного лечения (ЦИГК № 111/3 от 14.02.2018) отмечается устойчивая нормализация иммунного микроокружения кожи, снижение воспалительных маркеров и переход фенотипа от аутоагрессивного к репаративно-гомеостатическому.
Жизнеспособность клеток – 98 %, что указывает на высокое качество клеточной суспензии и восстановление трофики кожи. Цитоиммунный профиль демонстрирует отчетливое снижение воспалительной активности и переход к репаративному типу фенотипа после проведенной терапии.
Эпидермальные и стромальные клетки:
Клетки Лангерганса (CD207+). Всего – 29 %, из них:
Общее снижение содержания клеток Лангерганса по сравнению с фазой до лечения (с 54 % до 29 %) свидетельствует о нормализации антигенпрезентирующей активности и завершении аутоиммунной реакции в эпидермисе.
Эндотелиальные клетки (CD146+). Всего – 21,1 %, активированные (CD54+ HLA-DR+) – 4,3 %. Данные указывают на восстановление сосудистого эндотелия и снижение признаков васкулита, ранее сопровождавшего воспалительный процесс.
Тучные клетки (CD249+). Общее количество – 10,2 %, активированных (CD63+) – 0,9 %. Резкое уменьшение доли дегранулированных тучных клеток отражает подавление аллергоподобного воспаления и стабилизацию мембранных рецепторов.
Моноциты (CD45+ CD14+). Всего – 2 %, активированных (HLA-DR+) – 1,5 %. Незначительное повышение активных форм в сравнении с фазой до лечения говорит о физиологической активности макрофагов на этапе ремоделирования тканей.
Эпидермальные лимфоциты (CD45+ CD3+). Всего – 34 %, из них:
Нормализация CD4/CD8-соотношения и отсутствие NK- и B-клеток отражают завершение аутоиммунной активации и переход иммунного ответа в регуляторную фазу.
Заключение. После лечения отмечается отчетливая нормализация цитоиммунного профиля кожи:
Картина соответствует фазе ремиссии пузырчатки вульгарной. Фенотипическая динамика кожи больной Я. подтверждает следующее:
Следовательно, фенотипический анализ подтверждает диагностическую ценность метода цитоиммунограммы кожи для мониторинга динамики аутоиммунных дерматозов.
Таким образом, назначение разработанного биотехнологического средства «Cellgel» выглядит обоснованным для включения в комплекс мероприятий топической терапии больных, страдающих вульгарной пузырчаткой. Выделение фенотипа клеток CD34+ CD45dim позволило методически строго подойти к разработке ранозаживляющего средства «Cellgel», в последующем ставшего многократным лауреатом Всероссийского конкурса Программы «100 лучших товаров России» и регионального конкурса Программы «100 лучших товаров Тюменской области».
Термин «амплификация», введенный Р. Декартом в «Метафизических размышлениях» означал «усиление», но мы используем это слово в качестве имени к техническому изобретению, трактуя его как активатор репаративных потенций, коими обладает клетка кожи и, которые могут быть функционально прогрессивно проявлены.
В одной из концептуальных схем был выделен видовой концепт одного из фенотипов клеток кожи, по отношению к которому была поставлена задача разработки технического устройства для избирательной активации in vitro клеток кожи определенного фенотипа. С учетом результатов концептуализации решение обозначенной задачи было сформулировано так.
Среди полного разнообразия фенотипов субпопуляций видовых клеток с наборами их функций, заданных концептуальной схемой D3, найти фенотип, образованный из групп клеток разного вида с совпадающими признаками и, следовательно, функциями, который определяется следующим термом:
Т4 = {t ∈ B(Х1) | (x1 ∈ t) & (x2 ∈ t) ⇒ ((∃d1 ∈ D) & (∃d2 ∈ D) & (pr1 d1 = x1) & (pr1 d2 = x2) & (pr2 d1 = pr2 d2))}.
На его основании разработать техническое устройство, способное активировать функции клеток.
В результате решения этой задачи был разработан амплификатор репаративных потенций клеток кожи – устройство для избирательной активации in vitro клеток кожи определенного фенотипа 120. С одной стороны, это устройство – отклик на потребность внедрения в медицинскую практику экспертных систем 121. С другой стороны – оно открывает возможность создания ряда решений по так называемой «адресной доставке» активных веществ, перспективы которой в практической дерматологии были обозначены российскими и зарубежными авторами 122 123 124.
Полезная модель амплификатора репаративных потенций относится к биотехнологиям в клеточной медицине, а именно к устройствам для работы с клетками кожи человека, создающим практическое удобство активации in vitro и внесения в рану активированных клеток кожи. Это первый практический шаг использования открывшихся возможностей изучения свойств фенотипов субпопуляций клеток кожи и целенаправленное регулирование этих свойств (активация, подавление, усиление, видоизменение и пр.) с учетом индивидуальных потребностей пациентов.
При осуществлении полезной модели поставленная задача решается за счет активации репаративных потенций клеток кожи в устройстве, содержащем емкости из непрозрачного материала в форме усеченных конусов вставляемых друг в друга, которые дополнительно имеют на боковой поверхности выступающие кольцевые буртики с симметричными фасками для герметизации, причем верхний усеченный конус заполнен активатором, верхний конец верхнего усеченного конуса закрыт плоской глухой крышкой, а его нижний торец представляет собой мембрану с равномерно распределенными отверстиями диаметром 5-7 мкм, при этом нижний усеченный конус заполнен жизнеспособной гетерогенной популяцией клеток кожи в виде суспензии. На схеме представлен общий вид устройства (рис. 87).
Рисунок 87. Схема устройства полезной модели для избирательной активации in vitro клеток кожи определенного фенотипа – амплификатор репаративных потенций.
В целом, устройство состоит из верхнего усеченного конуса, имеющего на боковой поверхности, выступающий наружу конуса, кольцевой буртик, кольцевого буртика на боковой поверхности верхнего усеченного конуса, выступающего наружу конуса для фиксации нижнего усеченного конуса, кольцевого буртика на верхнем торце верхнего усеченного конуса, выступающего наружу конуса для фиксации крышки, глухой плоской крышки, мембраны в нижнем торце верхнего усеченного конуса, равномерно распределенных отверстий диаметром 5-7 мкм в мембране нижнего торца верхнего усеченного конуса, внутренней полости верхнего усеченного конуса, заполненной активатором, нижнего усеченного конуса, кольцевого буртика на верхнем торце нижнего усеченного конуса, выступающего внутрь конуса, нижнего торца нижнего усеченного конуса, который является глухим, внутренней полости нижнего усеченного конуса, заполняемой разделенной жизнеспособной гетерогенной популяцией клеток кожи в виде суспензии.
Герметичность соединения верхнего усеченного конуса с нижним обеспечивается выступающими кольцевыми буртиками (2 и 9) на их боковой поверхности и благодаря конусной форме емкостей в результате постоянного поджатия нижнего усеченного конуса к верхнему. При этом буртики имеют симметричные фаски для облегчения соединения усеченных конусов друг с другом. Кроме того, герметичность нижнего усеченного конуса дополнительно обеспечивается гидравлическим затвором, образованным действующим веществом в верхнем усеченном конусе, что препятствует возможному проникновению чего-либо из окружающей среды в активируемые клетки кожи.
Устройство работает следующим образом (рис. 88). Первоначально верхний усеченный конус (1) заполняют активатором и фиксируют на буртике (3) глухую плоскую крышку (4) для герметизации. Нижний усеченный конус (8) заполняют разделенной жизнеспособной гетерогенной популяцией клеток кожи в виде суспензии (11). Соединяют усеченные конусы между собой, вставляя верхний усеченный конус (1) в нижний (8), до фиксации их буртиками (2 и 9). После этого, в разделенную жизнеспособную гетерогенную популяцию клеток кожи начинают диффундировать по градиенту плотности через отверстия (6) диаметром 5-7 мкм в мембране (5) верхнего усеченного конуса (1) биологически активные молекулы из действующего вещества, активируя клетки эпидермиса и дермы в суспензии (11), которые начинают вырабатывать биологически активные вещества. По истечении требуемого времени активации, отгибают буртик (9), разделяют усеченные конусы и извлекают активированные клетки кожи из нижнего конуса (8).
Рисунок 88. Кольцевые буртики устройства, обеспечивающие герметичность соединения верхнего усеченного конуса с нижним. Крышка устройства, обеспечивающая герметичность верхнего усеченного конуса
Учитывая потребность накопления достаточного количества клеток в культуре, например с целью лечения ожогового больного, как правило, необходимо их субпассирование в течение нескольких недель (2-3 пересева). Чтобы клетки были способны к размножению, они должны находиться не в терминальной стадии своего развития. Столь длительное время подготовки клеток отрицательно сказывается на исходах их применения. При использовании амплификатора репаративных потенций происходит необходимое условие – быстрое (считанные часы) накопление клеточной биомассы, клетки которой активно пролиферируют и продуцируют активные вещества необходимые для репарации.
Обеспечение ограниченного контакта активирующего вещества, которое позволяет не только культивировать клетки кожи, но и активировать их к выработке биологически активных веществ, способствующих возникновению репаративных потенций, с активируемыми клетками кожи происходит в результате размещения в верхнем усеченном конусе действующего вещества – активатора, биологически активные молекулы которого, благодаря градиенту плотности, диффундируют через мембрану с диаметром отверстий 5-7 мкм к активируемым клеткам кожи, находящимся в нижнем усеченном конусе. Диаметр отверстий в мембране выбран исходя из размеров клеток кожи, которые составляют от 8 мкм до 15 мкм, для предотвращения проникновения клеток кожи из нижнего усеченного конуса в активирующее вещество. Таким образом, часть активирующего вещества (7) оказывается погруженной в суспензию разделенной жизнеспособной гетерогенной популяции клеток кожи (11). Для обеспечения герметичности верхний усеченный конус снабжен глухой плоской крышкой (4), представленной на рис 88.
Все конструктивные элементы устройства изготавливаются из непрозрачного материала химически инертного по отношению к активирующему веществу и разделенной жизнеспособной гетерогенной популяции клеток кожи – из медицинского полипропилена (рис. 89).

Рисунок 89. Компьютерное моделирование устройства – амплификатор репаративных процессов и изготовление прототипа из медицинского полипропилена на 3D-принтере.
Между заявленным техническим результатом и признаками амплификатора репаративных потенций существует причинно-следственная связь, которая позволила использовать его на практике.
Известно, что в коже млекопитающих преобладающими типами клеток являются фибробласты и кератиноциты 125, а также что они сохраняют способность синтезировать компоненты внеклеточного матрикса – коллаген, тропоэластин и фибронектин, а также способны удерживать гиалуроновую кислоту за счет высокого уровня экспрессии рецепторов HLA-DR и CD44+ на поверхности 126. Именно поэтому, в подавляющем большинстве исследований по заживлению ран in vitro, используют один или оба из этих типов клеток 127.
Выделение фибробластов и кератиноцитов в жизнеспособном состоянии, как объекта последующей активации, позволило не только количественно и функционально описать каждую клеточную субпопуляцию отдельно от всех других, но и в дальнейшем воздействовать на выделенные субпопуляции различными веществами, в том числе разработанным биотехнологическим средством, а также после криоконсервации биоптатов (табл. 18 и 19).
Таблица 18. Результаты активации клеток кожи человека цитокинами и биотехнологическим средством ксеногенного происхождения
|
Субпопуляции клеток кожи |
Фенотип |
Активация ксеногенным активатором |
Активация цитокинами |
||
|
75 мкг/мл активатора |
150 мкг/мл активатора |
IL-1 2мкг/мл |
IL-6 2мкг/мл |
||
|
Кератиноциты, из них активированные |
CD49f+ CD49f+ HLA-DR+ |
55,0 9,6 |
79,2 40,5 |
80,9 15,6 |
54,0 13,5 |
|
Фибробласты, |
CD45– CD14– CD44+ CD45– CD14– CD44+ CD80+ |
81,3 10,5 |
74,3 25,1 |
92,6 7,0 |
93,1 6,9 |
|
Клетки Лангерганса, |
CD207+ CD207+ CD80– HLA-DR+ CD207+ CD80+ HLA-DR– CD207+ CD80+ HLA-DR+ |
63,1 0,9 1,2 19,6 |
49,2 0,2 6,4 14,2 |
60,9 1,0 10,0 0,6 |
45,3 0 6,4 0 |
|
Эндотелиальные клетки, из них активированные |
CD146+ CD146+ CD54– HLA-DR+ CD146+ CD54+ HLA-DR– CD146+ CD54+ HLA-DR+ CD146+ CD34+ |
2,7 0 20,9 35,1 70,2 |
2,6 1,0 43,1 25,8 69,0 |
0,7 0,2 70,2 7,0 60,2 |
0,8 0 70,6 5,1 59,2 |
|
Тучные клетки, из них активированные |
CD249+ CD249+ CD63+ |
3,2 0,9 |
19,5 18,6 |
10,3 15,6 |
7,1 1,0 |
|
Моноциты, из них активированные |
CD45+ CD14+ CD45+ CD14+ HLA-DR+ |
9,5 3,2 |
20,3 10,6 |
5,8 1,0 |
7,0 2,9 |
|
Эпидермальные лимфоциты Т-общие Т-хелперы Т-цитотоксические В-лимфоциты NK-клетки |
CD45+ CD3+ CD45+ CD3+ CD4+ CD8– CD45+ CD3+ CD4– CD8+ CD45+ CD3+ CD19+ CD45+ CD3– CD16+ CD56+ |
12,0 9,0 3,0 15,2 10,6 |
14,1 11,3 1,9 14,7 14,0 |
13,2 10,0 3,0 6,9 10,2 |
12,9 10,3 2,4 15,9 11,1 |
В исследовании (табл. 18) изучена реакция основных субпопуляций клеток кожи человека in vitro на стимуляцию:
Оценивались изменения относительного количества клеток, экспрессирующих фенотипы активации (CD44+ CD80+ HLA-DR+ CD54+ CD63+ CD14+ и др.), что позволяет судить о переключении клеточного гомеостаза от состояния покоя к репаративной активности.
Результаты демонстрируют принципиально разные типы ответов на стимуляцию цитокинами и биотехнологическим комплексом, что имеет фундаментальное значение для управления репаративными процессами кожи.
Кератиноциты (CD49f+ HLA-DR+):
Таким образом, ксеногенный активатор индуцирует барьерно-регенераторный тип активации кератиноцитов, сочетая пролиферацию с умеренной антиген-презентацией. Цитокины вызывают более избирательные эффекты – IL-1 усиливает репарацию, IL-6 способствует нормализации и переходу к гомеостазу.
Фибробласты (CD45– CD14– CD44+ / CD80+):
Это отражает баланс стимуляции и модуляции: ксеногенный активатор вызывает активную фазу синтетической перестройки матрикса (аналог «вспышки репарации»), а цитокины обеспечивают мягкое дифференцировочное созревание и завершение регенерации.
Клетки Лангерганса (CD207+ CD80+ HLA-DR+):
Наблюдается контролируемая активация антиген-презентации – важная особенность ксеногенного воздействия, позволяющая включить каскад регенерации без перехода к воспалению.
Эндотелиальные клетки (CD146+ CD54+ CD34+):
Таким образом, ксеногенное средство стимулирует сосудисто-репаративный путь, в то время как цитокины обеспечивают его стабилизацию и морфогенетическое созревание капиллярной сети.
Тучные клетки (CD249+ / CD63+):
Это подтверждает, что ксеногенный активатор инициирует «старт» репарации через транзиторное воспаление, а цитокины выполняют роль физиологического «тормоза» при переходе к созреванию ткани.
Моноциты (CD45+ CD14+ / HLA-DR+):
Формируется M2-тип макрофагальной дифференцировки, направленный на очищение, ангиогенез и ремоделирование внеклеточного матрикса.
Эпидермальные лимфоциты:
Клеточная иммунная система сохраняет гомеостатическую направленность без перехода к аутоагрессии.
Биотехнологическое средство ксеногенного происхождения вызывает комплексную, физиологически согласованную активацию клеток кожи, приближенную к естественным фазам репарации:
Эта модель активации демонстрирует управляемую, неаутоиммунную регенерацию кожи, что подтверждает потенциал ксеногенного биотехнологического комплекса как универсального регулятора репарации и тканевого гомеостаза.
Таблица 19. Результаты активации клеток кожи человека TNFα и ИНФγ в нативных и криоконсервированных образцах
|
Субпопуляции клеток кожи |
Фенотип |
Образец ex tempore |
Образец после криоконсервации |
||||
|
% |
TNFα 2мкг/мл |
ИНФγ 2мкг/мл |
% |
TNFα 2мкг/мл |
ИНФγ 2мкг/мл |
||
|
Кератиноциты, из них активированные |
CD49f+ CD49f+ HLA-DR+ |
54,0 6,9 |
58,2 9,3 |
76,6 8,9 |
54,6 1,3 |
56,0 8,3 |
69,4 8,0 |
|
Фибробласты, |
CD45– CD14– CD44+ CD45– CD14– CD44+ CD80+ |
86 6,2 |
82,1 8,9 |
92,6 8,4 |
66,8 3,5 |
79,4 6,2 |
85,1 7,9 |
|
Клетки Лангерганса, |
CD207+ CD207+ CD80– HLA-DR+ CD207+ CD80+ HLA-DR– CD207+ CD80+ HLA-DR+ |
46,1 0 4,9 0,3 |
30,2 0 5,0 0,3 |
64,9 11,6 4,5 1,9 |
46,4 0 1,3 3,5 |
28,3 0 1,9 3,1 |
62,3 5,0 3,9 1,0 |
|
Эндотелиальные клетки, из них активированные |
CD146+ CD146+ CD54– HLA-DR+ CD146+ CD54+ HLA-DR– CD146+ CD54+ HLA-DR+ CD146+ CD34+ |
0,6 0 60,3 5,4 59,0 |
0,9 0,1 15,9 1,2 35,2 |
1,9 1,5 20,0 2,3 62,0 |
0,6 0 50,0 0 36,0 |
0,8 0 16,1 0,9 29,1 |
1,6 0,5 22,3 1,9 44,0 |
|
Тучные клетки, из них активированные |
CD249+ CD249+ CD63+ |
6,8 1,1 |
6,5 1,3 |
10,7 9,8 |
2,5 1,6 |
4,7 1,9 |
9,2 7,1 |
|
Моноциты, из них активированные |
CD45+ CD14+ CD45+ CD14+ HLA-DR+ |
7,0 2,6 |
22,0 6,8 |
24,5 3,8 |
5,6 0 |
16,2 2,6 |
19,3 3,0 |
|
Эпидермальные лимфоциты Т-общие Т-хелперы Т-цитотоксические В-лимфоциты NK-клетки |
CD45+ CD3+ CD45+ CD3+ CD4+ CD8– CD45+ CD3+ CD4– CD8+ CD45+ CD3+ CD19+ CD45+ CD3– CD16+ CD56+ |
13,0 11,9 1,2 8,1 12,5 |
16,2 14,0 2,2 15,3 23,6 |
25,0 15,0 5,0 9,2 18,2 |
11,2 9,9 1,3 7,0 9,5 |
12,9 10,0 2,9 13,2 20,6 |
19,3 13,5 5,8 8,6 16,2 |
Исследование (табл. 19) показывает, как ксеногенное биотехнологическое средство модулирует реактивность основных клеточных субпопуляций кожи человека при воздействии провоспалительных цитокинов TNF-α и IFN-γ, моделирующих условия иммунного стресса и репарации.
Сравнение проводилось между:
Кератиноциты (CD49f+ HLA-DR+):
Интерпретация: оба цитокина индуцируют активацию кератиноцитов по пути антиген-презентации, но IFN-γ вызывает более выраженный фенотип иммунного «пробуждения», в то время как TNF-α преимущественно стимулирует регенеративную пролиферацию. Даже после криоконсервации кожа сохраняет пластичность и способность к регенерации, что подчеркивает устойчивость эпидермального резерва.
Фибробласты (CD45– CD14– CD44+ / CD80+):
Это говорит о том, что ксеногенный биокомплекс молекул обеспечивает «анаболическую память» фибробластов – способность сохранять регенеративный потенциал даже после криостресса и при цитокиновом воздействии.
Клетки Лангерганса (CD207+ CD80+ HLA-DR+):
Таким образом, IFN-γ активирует иммунное звено эпидермиса по Th1-типу, тогда как TNF-α поддерживает структурное обновление без чрезмерного воспаления.
Эндотелиальные клетки (CD146+ CD54+ CD34+):
Следовательно, ксеногенное средство стабилизирует эндотелиальный резерв даже после криоконсервации, что крайне важно для восстановления микроциркуляции при трансплантациях и хронических дерматозах.
Тучные клетки (CD249+ CD63+):
Это отражает модуляцию паравоспалительного механизма: ксеногенный стимул не вызывает избыточной дегрануляции, а обеспечивает сбалансированное высвобождение факторов роста (VEGF, FGF, TGF-β).
Моноциты (CD45+ CD14+ / HLA-DR+):
Это подтверждает участие ксеногенного комплекса в формировании противовоспалительного макрофагального профиля, поддерживающего репарацию без хронического воспаления.
Эпидермальные лимфоциты:
Цитокины совместно с биокомплексом восстанавливают иммунный баланс Th1/Th2 и стимулируют естественные механизмы надзора без повреждения эпидермиса.
Таким образом:
Полученные результаты активации позволили спланировать оценку эффективности разработанной полезной модели у больного с повреждением кожи.
Демонстрируется пациент А., 35 лет с диагнозом: Термический ожог лица пламенем IIIА степени, S = 5%. Ожидаемые результаты от традиционного лечения: средний срок формирования грануляций при ожоговых ранах IIIА составляет 21 день и средний срок пребывания в стационаре пациентов с глубокими ожогами – 30-35 дней.
Лечение ожога проходило с использованием амплификатора репаративных потенций для ксеногенной активации аутологичных фибробластов и кератиноцитов. Работающая концентрация составила 1 миллион клеток в 1 мл (рис. 90 и рис. 91).
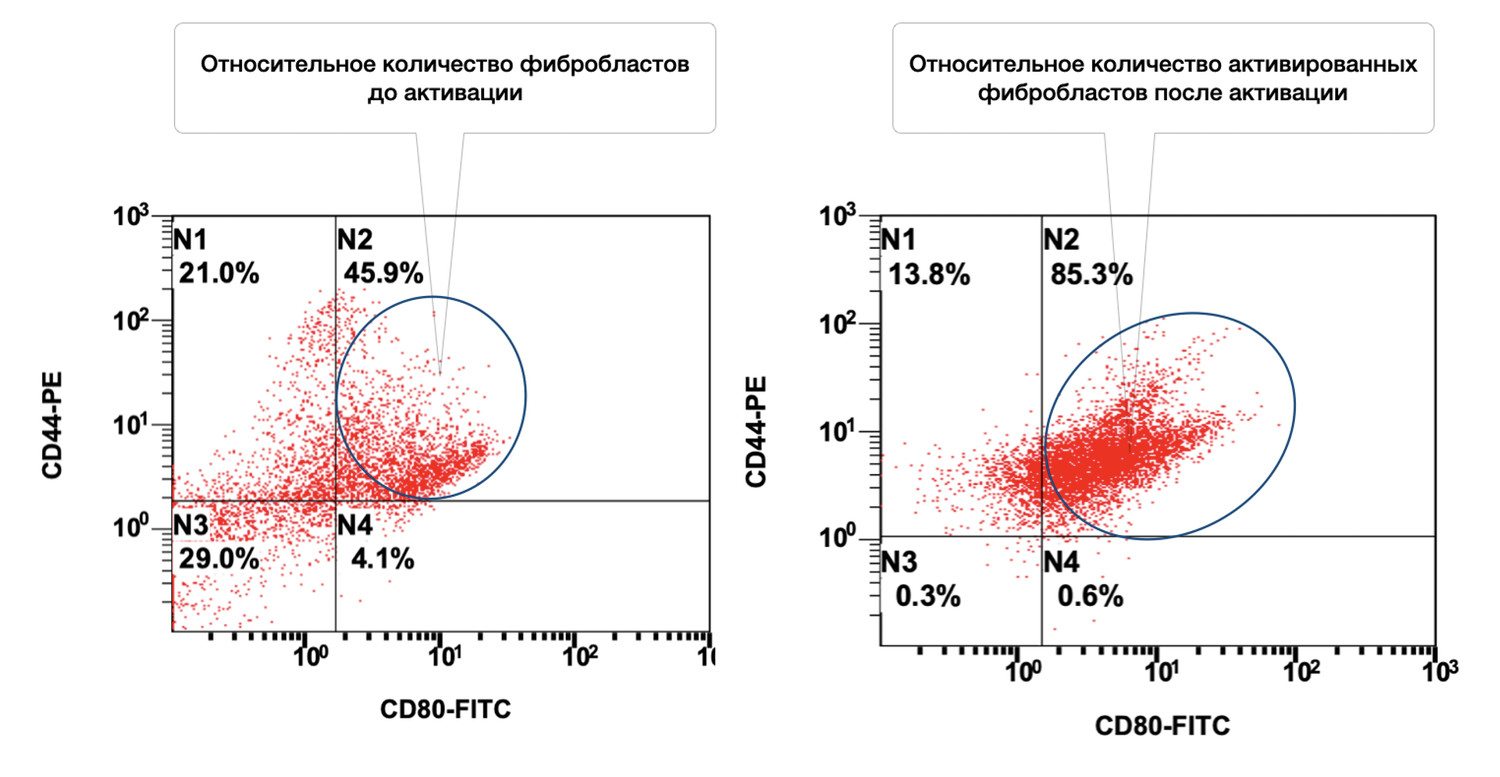
Рисунок 90. Сравнительная характеристика относительного количества жизнеспособных фибробластов (фенотип CD45-CD14-CD44+) до активации и после, в суспензии клеток биоптатов кожи пациента А., 35 лет с диагнозом: Термический ожог пламенем лица IIIА степени
Цитоиммунограммы иллюстрируют сравнительный анализ экспрессии маркеров CD80 и CD44 фибробластов кожи до и после активации, выполненный методом проточной цитометрии.
На левом фрагменте диаграммы (до активации) выделяется популяция клеток с умеренной экспрессией CD44 и низкой экспрессией CD80:
Квадрант N2 (CD44⁺/CD80⁺): 45,9%. Жизнеспособные, частично активированные фибробласты.
Квадрант N1 (CD44⁺/CD80–): 21,0%. Жизнеспособные, но неактивированные фибробласты.
Квадрант N3 (CD44–/CD80–): 29,0%. Вероятно, другие типы клеток, не относящиеся к фибробластам.
Квадрант N4 (CD44–/CD80⁺): 4,1%. Вероятно, неспецифические активированные клетки, не являющиеся фибробластами.
Суммарное относительное количество жизнеспособных фибробластов составляет ~66,9%, из которых значительная часть — с признаками умеренной активации (CD80⁺).
На правом фрагменте цитоиммунограммы — резкий сдвиг популяционной структуры в сторону высокой экспрессии CD80:
Квадрант N2 (CD44⁺/CD80⁺): 85,3%. Активированные жизнеспособные фибробласты.
Квадрант N1 (CD44⁺/CD80–): 13,8%. Неактивированные фибробласты остаются в незначительном количестве.
Квадрант N3 (CD44–/CD80–): 0,3%.
Квадрант N4 (CD44–/CD80⁺): 0,6%
Практически вся жизнеспособная фибробластная популяция перешла в активированное состояние (85,3%), что указывает на эффективность воздействия активирующего агента.
Обобщение
|
Параметр |
До активации |
После активации |
|---|---|---|
|
CD44⁺/CD80⁺ (N2) |
45,9% |
85,3% 🔺 |
|
CD44⁺/CD80– (N1) |
21,0% |
13,8% 🔻 |
|
CD44–/CD80– (N3) |
29,0% |
0,3% 🔻 |
|
CD44–/CD80⁺ (N4) |
4,1% |
0,6% 🔻 |
Таким образом, после активации происходит выраженное смещение фибробластной популяции в зону высокой активации, что подтверждается более чем вдвукратным увеличением доли CD44⁺CD80⁺ клеток. Это демонстрирует:
Высокий потенциал фибробластов к активации in vitro;
Эффективность используемого активирующего воздействия;
Перспективность клеточной терапии ожогов с акцентом на модуляцию активности фибробластов.
После активации наблюдается значительное увеличение доли фибробластов, коэкспрессирующих CD80 и CD44 (N2), с 45.9% до 85.3%, что отражает высокоэффективную стимуляцию клеточной активности. Одновременное снижение популяций N1, N3 и N4 подтверждает направленное действие активации и перераспределение клеток в сторону функционально значимой популяции. Это может свидетельствовать о потенциале применяемого воздействия для стимуляции регенерации дермы и повышения клеточного метаболизма.
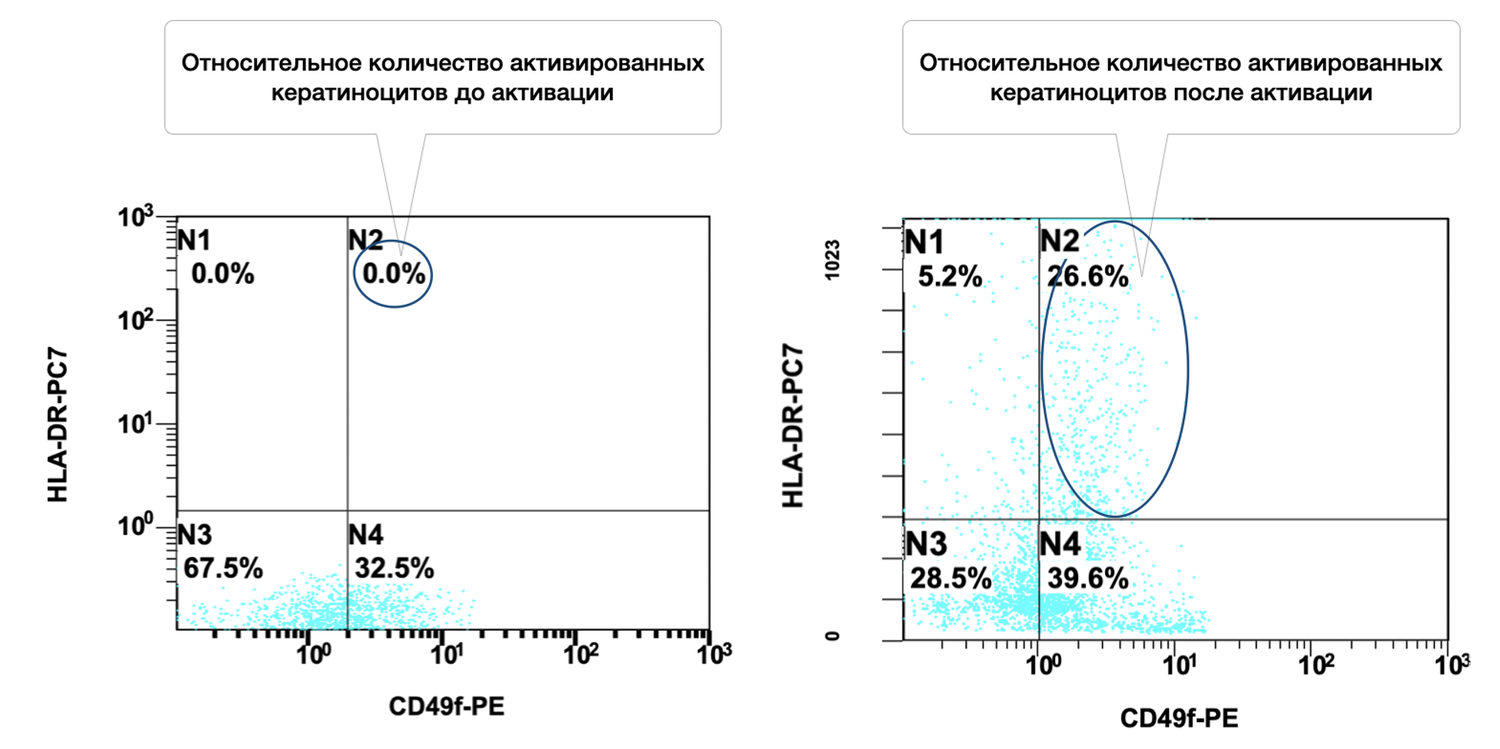
Рисунок 91. Сравнительная характеристика относительного количества жизнеспособных кератиноцитов (фенотип CD49f+HLA-DR+) до активации и после, в суспензии клеток биоптатов кожи пациента А., 35 лет с диагнозом: Термический ожог пламенем лица IIIА степени
Анализ цитоиммунограмм пациента А., 35 лет, с диагнозом: термический ожог пламенем лица IIIА степени подробно характеризует изменения в популяции жизнеспособных кератиноцитов (фенотип CD49f⁺ HLA-DR⁺) до и после активации.
До активации:
Квадрант N2 (CD49f⁺ / HLA-DR⁺): 0,0%. Активированные жизнеспособные кератиноциты отсутствуют. Это указывает на исходную иммуносупрессию эпидермального слоя или глубокое повреждение.
Квадрант N4 (CD49f⁺ / HLA-DR⁻): 32,5%. Жизнеспособные, но неактивированные кератиноциты.
Квадрант N1 и N3 (остальные клетки) — N1: 0,0% и N3: 67,5% – клетки без признаков жизнеспособности или не относящиеся к кератиноцитам.
Кератиноциты практически полностью находятся в неактивном состоянии. Отсутствие CD49f⁺/HLA-DR⁺ клеток говорит о подавленном регенераторном ответе.
После активации:
Квадрант N2 (CD49f⁺ / HLA-DR⁺): 26,6%. Существенное появление активированных жизнеспособных кератиноцитов. Это ключевой маркер начала регенераторных процессов.
Квадрант N4 (CD49f⁺ / HLA-DR⁻): 39,6%. Часть клеток остается неактивированной, но жизнеспособной.
Квадрант N1: 5,2%, N3: 28,5%
Наблюдается существенное увеличение доли активированных кератиноцитов (CD49f⁺ / HLA-DR⁺) — с 0% до 26,6%, что указывает на восстановление пролиферативного потенциала эпидермиса.
Обобщающая таблица
|
Параметр |
До активации |
После активации |
|---|---|---|
|
CD49f⁺ / HLA-DR⁺ (N2) |
0,0% |
26,6% 🔺 |
|
CD49f⁺ / HLA-DR⁻ (N4) |
32,5% |
39,6% 🔺 |
|
CD49f⁻ / HLA-DR⁻ (N3) |
67,5% |
28,5% 🔻 |
|
CD49f⁻ / HLA-DR⁺ (N1) |
0,0% |
5,2% 🔺 |
После активации наблюдается чёткий сдвиг в сторону восстановления функции эпидермиса, выражающийся в появлении значительной доли активированных кератиноцитов. Это подтверждает эффективность применённого активирующего воздействия, указывает на способность клеточного состава кожи пациента к регенерации, демонстрирует потенциальную клиническую перспективу терапии ожогов с участием клеточной модуляции.
За время лечения выполнено 25 перевязок. Учитывая локализацию, площадь и глубину поражения, после нанесения суспензии клеток, содержащей культуру активированных кератиноцитов и фибробластов, накладывались стерильные марлевые повязки, перевязки выполнялись один раз в день (рис. 92). В результате лечения в области ожоговых ран сформировались яркие, сочные грануляции на 15-й день с момента травмы. Перевязки под наркозом проводились только при первой и второй процедурах.
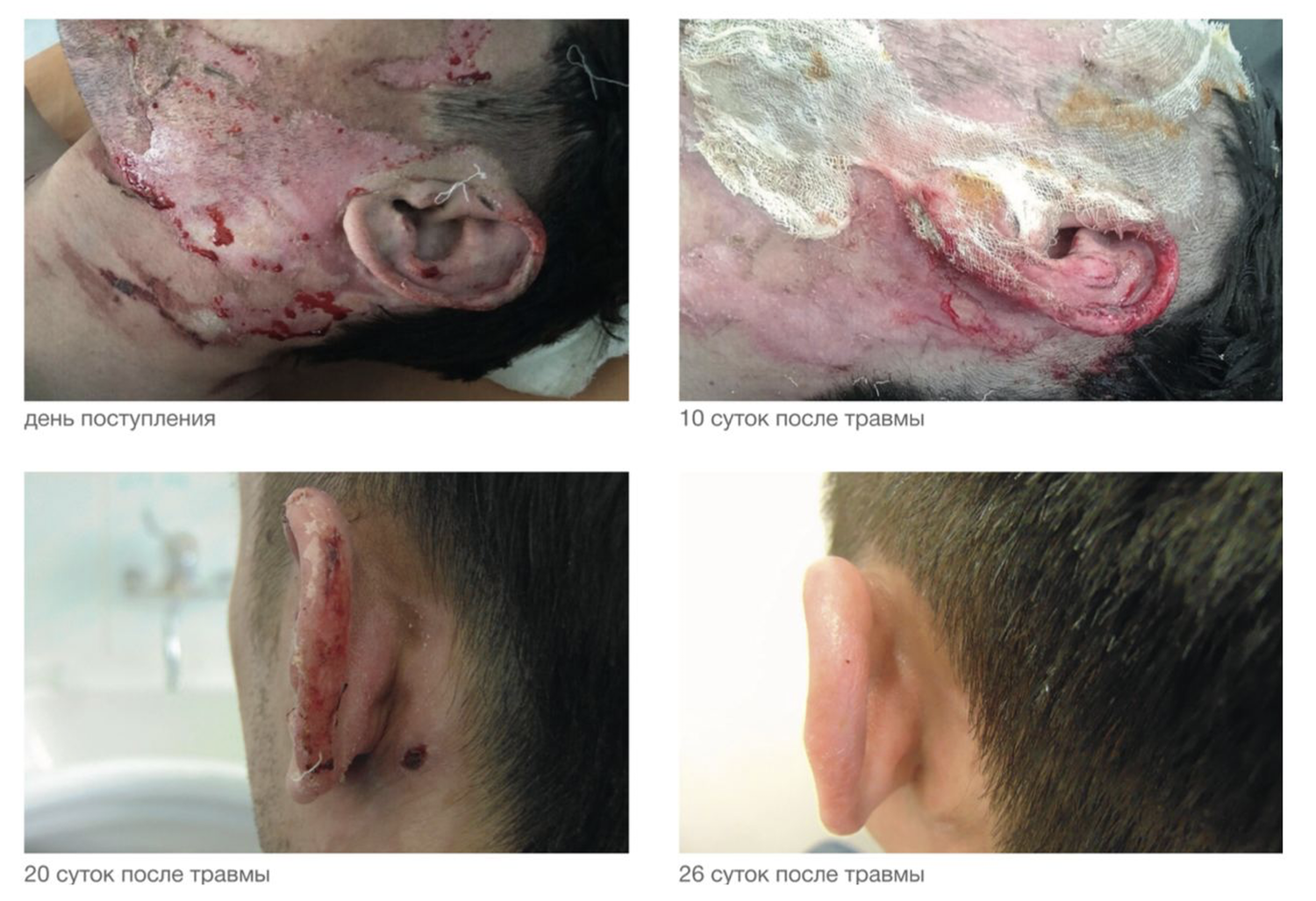
Рисунок 92. Клиническая эффективность применения культуры фибробластов и кератиноцитов активированных амплификатором репаративных потенций. Пациент А., 35 лет.
1. Термический ожог пламенем лица IIIА степени, S = 5%.
2. Формируется грануляционный слой (десятый день с момента травмы).
3. Грануляции сформированы и очаг эпителизирован (20-й день с момента травмы).
4. Результат заживления и восстановления (26-й день с момента травмы).
Врачебным консилиумом отмечено преимущество применения активатора репаративных потенций в подготовке клеток к аутотрансплантации при лечении ожога, а именно более короткие сроки эпителизации ран, что позволило уменьшить срок госпитализации пациента на десять дней.
В итоге, клиническая картина у пациента А., 35 лет, после термического ожога лица IIIА степени коррелирует с результатами цитоиммунограммы.
Клиническая динамика восстановления кожи:
День поступления
Глубокое повреждение кожи лица и шеи.
Признаки массивного некроза, разрушения эпидермиса и дермы.
Явная угроза рубцевания и деформации уха.
10 суток после травмы
Формируется грануляционный слой — признак начала активного регенераторного процесса.
Отмечается очищение поверхности, уменьшение воспаления.
Область ожога активно покрывается молодой тканью.
20 суток после травмы
Грануляционная ткань начинает эпителизироваться.
Видны участки новой кожи с восстановлением текстуры и пигментации.
Отёк и гиперемия значительно уменьшены.
26 суток после травмы
Практически полное восстановление кожного покрова.
Ухо полностью сохранено, без рубцовой деформации.
Текстура кожи ровная, однородная — свидетельство успешной репарации с минимальными последствиями.
Результаты цитоиммунограммы, показавшие активацию фибробластов (до 85,3%) и появление активированных кератиноцитов (до 26,6%), напрямую коррелируют с:
ускоренным формированием грануляционной ткани и активацией эпителизации,
значительным сокращением сроков заживления и снижением риска осложнений. Врачебным консилиумом отмечено преимущество применения активатора репаративных потенций в подготовке клеток к аутотрансплантации при лечении ожога, а именно более короткие сроки эпителизации ран, что позволило уменьшить срок госпитализации пациента на десять дней.
Этот клинический случай служит яркой иллюстрацией эффективности применения активированных аутологичных клеточных культур (фибробластов и кератиноцитов) на основе использования амплификатора репаративных процессов. Совокупность лабораторных и визуальных данных демонстрирует быстрое восстановление целостности кожи, регенерацию с минимальными рубцами, сохранение анатомических структур.
Демонстрируется пациент С., 65 лет с диагнозом: Термический ожог тыла кисти пламенем IIБ степени, S = 2%. Лечение ожога осуществлялось в условиях монотерапии с использованием амплификатора репаративных потенций для ксеногенной активации аутологичных кератиноцитов. Работающая концентрация составила 1 миллион клеток в 1 мл (рис. 93).
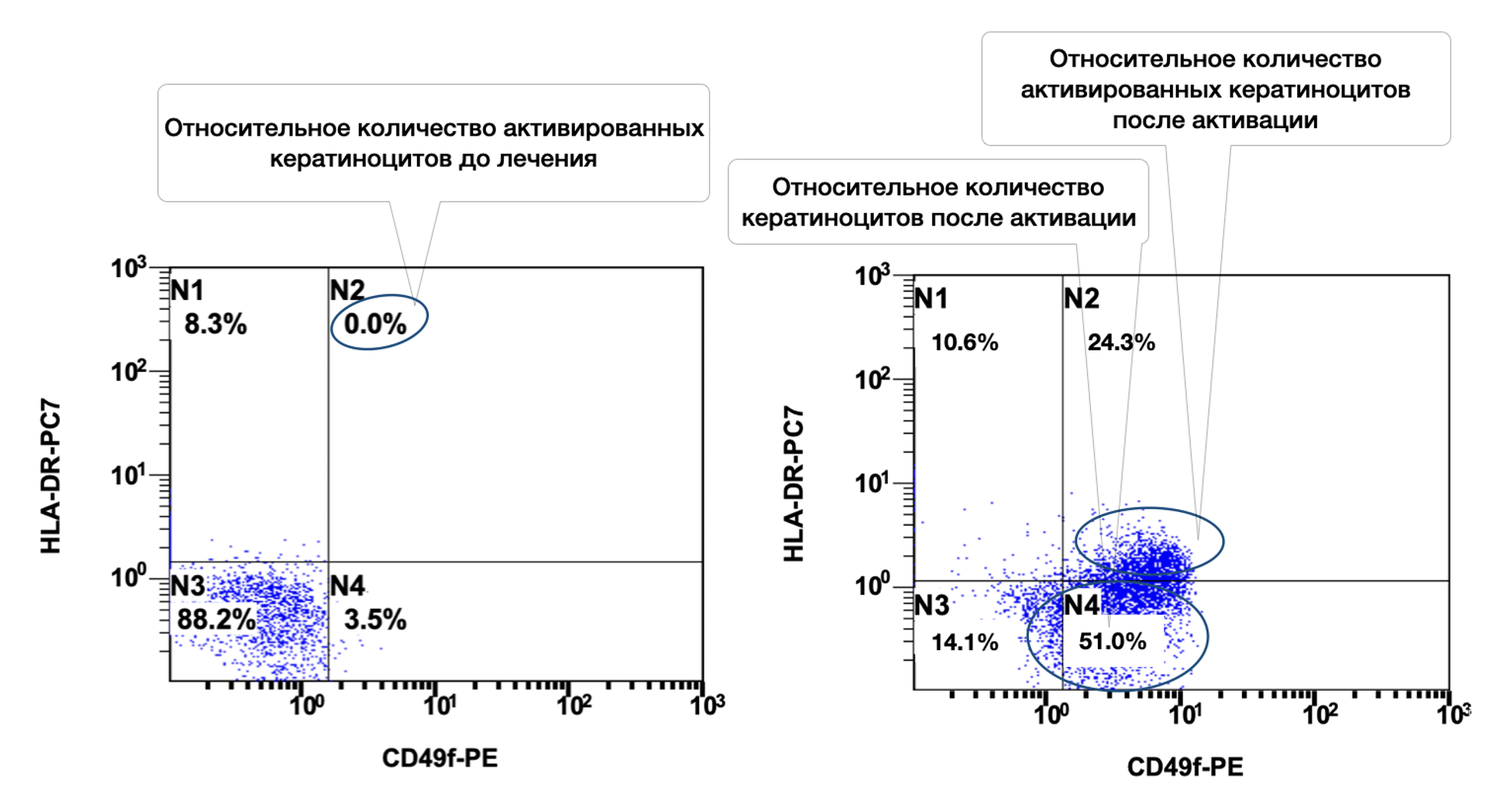
Рисунок 93. Сравнительная характеристика относительного количества жизнеспособных кератиноцитов (фенотип CD49f+HLA-DR+) до активации и после в суспензии клеток биоптатов кожи пациента С., 65 лет с диагнозом: Термический ожог тыла кисти пламенем IIБ степени
Динамика в представленных цитоиммунограммах кожи, отражает изменение относительного количества жизнеспособных кератиноцитов (фенотип CD49f⁺ HLA-DR⁺) до и после активации у пациента С., 65 лет, с диагнозом: термический ожог тыла кисти пламенем IIБ степени:
|
Сектор |
Обозначение |
Интерпретация |
|---|---|---|
|
N2 |
CD49f⁺ HLA-DR⁺ |
Активированные кератиноциты |
|
N4 |
CD49f⁺ HLA-DR⁻ |
Зрелые/неактивные кератиноциты |
|
N1 / N3 |
CD49f⁻ |
Неспецифические популяции |
До активации:
Относительное количество активированных кератиноцитов (CD49f⁺ HLA-DR⁺, сектор N2): 0.0%
Основная масса клеток (88.2%) локализована в секторе N3, соответствующем кератиноцитам без экспрессии CD49f и HLA-DR (возможно, неактивные или повреждённые клетки).
Зрелых, но неактивных кератиноцитов (N4): 3.5%
Картина указывает на подавленное состояние эпидермального компонента с отсутствием признаков регенераторной активности.
После активации:
Относительное количество активированных кератиноцитов (N2) значительно увеличилось до 24.3%
Параллельно наблюдается увеличение доли зрелых, но неактивных кератиноцитов (N4) до 51.0%
Значительное снижение доли "неспецифических" или потенциально апоптотических клеток (N3: 14.1% против 88.2% до активации)
Совокупные данные говорят о восстановлении клеточной структуры и запуске регенерации эпидермиса, что особенно важно для поверхностных ожогов IIБ степени
Таким образом, активация кератиноцитов вызвала четкую смену цитометрического профиля, выразившуюся:
в де-дифференцировке и репрограммировании части зрелых клеток;
в появлении регенераторной субпопуляции, экспрессирующей HLA-DR (N2);
в снижении "молчаливых" или неактивных клеток.
Таким образом, в условиях ожога тыла кисти у пожилого пациента запуск активации кератиноцитов может рассматриваться как критически важное звено восстановления кожного барьера. За время лечения выполнено 14 перевязок, которые выполнялись один раз в день (рис. 94).
Рисунок 94. Клиническая эффективность применения культуры кератиноцитов активированных амплификатором репаративных потенций. Пациент С., 65 лет с диагнозом: Термический ожог тыла кисти пламенем IIБ степени
1. Термический ожог тыла кисти пламенем IIБ степени
2. Результат заживления и восстановления (14-й день с момента травмы).
Эта пара фотографий наглядно демонстрирует, как лабораторные (цитоиммунологические) данные коррелируют с клиническим восстановлением кожного покрова у пациента С., 65 лет с термическим ожогом тыла кисти IIБ степени.
Слева (до лечения): выраженное воспаление, пузыри, мокнущие эрозии и отек, характерные для ожога IIБ степени.
Справа (14-й день): полная эпителизация кожи, исчезновение отека, нормализация окраски и текстуры, отсутствие грубых рубцов.
|
Параметр |
До лечения |
После активации кератиноцитов |
Клинический результат |
|---|---|---|---|
|
CD49f⁺ HLA-DR⁺ (активированные кератиноциты) |
0.0% |
24.3% |
Обширные эрозии и отек → гладкий, репителизированный кожный покров |
|
Общая жизнеспособность кератиноцитов |
Низкая: 3.5% зрелых (CD49f⁺ HLA-DR⁻) |
Повышена до 51.0% |
Явное восстановление структуры кожи |
|
Цитометрические изменения |
Дефицит регенераторной активности |
Выраженная активизация эпидермальных клеток |
Подтверждение успешного восстановления в течение 14 дней |
Полученный результат лечения свидетельствует об эффективности применения культуры активированных кератиноцитов, усиленных амплификатором репаративных потенций, и о том, что это:
Мы наблюдаем пример прямой связи иммуноцитологического воздействия с клиническим эффектом (что особенно ценно при оценке эффективности инновационной терапии ожогов), который отмечает объективную результативность применения активатора репаративных потенций в подготовке культуры кератиноцитов к аутотрансплантации при лечении ожога, а именно более короткие сроки эпителизации раны и выраженный эстетический эффект.
57 Гмурман, В. Е. Теория вероятностей и математическая статистика / В. Е. Гмурман. – Изд. 7-е, стер. – М.: Высшая школа, 2000. – 479 с.
58 Федеральные клинические рекомендации. Дерматовенерология 2015: Болезни кожи. Инфекции, передаваемые половым путем. – М. : Деловой экспресс, 2016. – 768 с.
59 Федеральные клинические рекомендации. Дерматовенерология 2015: Болезни кожи. Инфекции, передаваемые половым путем. – М. : Деловой экспресс, 2016. – 768 с.
60 Завгородняя, М. И. Клеточные и молекулярные основы заживления ран / М. И. Завгородняя, Л. В. Макеева, О. С. Славчева и др. // Morphologia. – 2016. – Т. 10. – № 3. – С. 19–23.
61 Li, J. Pathophysiology of acute wound healing / J. Li, J. Chen, R. Kirsner // Clinical Dermatology. – 2007. – Т. 25. – Р. 9–18.
62 Werner, S. Regulation of wound healing by growth factors and cytokines / S. Werner, R. Grose // Physiol. Rev. – 2003. – Т. 83. – Р. 835–870.
63 Алексеева, Н. Т. Роль клеток фибробластического дифферона в процессе заживления ран / Н. Т. Алексеева, А. А. Глухов, А. П. Остроушко // Вестник экспериментальной и клинической хирургии. – 2012. – Т. 5. – № 3. – С. 601–608.
64 Rittié, L. Cellular mechanisms of skin repair in humans and other mammals / L. Rittié // Journal of Cell Communication and Signaling. – 2016. – Т. 10 (2). – Р. 103–120.
65 Donati, G. Stem cell heterogeneity and plasticity in epithelia / G. Donati, F. M. Watt // Cell Stem Cell. – 2015. – Т. 16. – Р. 465–476.
66 Pal'tsev, M. A. Biologiya stvolovykh kletok i kletochnye tekhnologii / Pod red. M. A. Pal'tseva. – M.: Meditsina, 2009. –728 s.
67 Barinov, E. F. Histophysiology of hair follicles: current concept / E. F. Barinov, O. N. Sulaeva // Uspekhi fiziologicheskikh nauk. – 2003. – № 35 (4). – P. 65–77.
68 Rehman, J. Peripheral blood «endothelial progenitor cells» are derived from monocyte/macrophages and secrete angiogenic growth factors / J. Rehman, J. Li, C. M. Orschell et al. // Circulation. – 2003. – Т. 107. – Р. 1164–1169.
69 Chu, K. Distribution and in situ proliferation patterns of intravenously injected immortalized human neural stem-like cells in rats with focal cerebral ischemia / K. Chu, M. Kim, S. H. Chae et al. // Neuroscience Research. – 2004. – Т. 50 (4). – Р. 459–465.
70 Shintani, S. Augmentation of postnatal neovascularization with autologous bone marrow transplantation / S. Shintani, T. Murohara, H. Ikeda et al. // Circulation. – 2001. – Т. 103. – Р. 897–903.
71 Баринов, Э. Ф. Функциональная морфология кожи: от основ гистологии к проблемам дерматологии / Э. Ф. Баринов, Р. Ф. Айзятулов, М. Э. Баринова и др. // Клиническая дерматология и венерология. – 2012. – Т. 10. – № 1. – С. 90–93.
72 Kamihata, H. Implantation of bone marrow mononuclear cells into ischemic myocardium enhances collateral perfusion and regional function via side supply of angioblasts, angiogenic ligands, and cytokines / H. Kamihata, H. Matsubara, T. Nishiue et al. // Circulation. – 2001. – Т. 104. – Р. 1046–1052.
73 Donati, G. Stem cell heterogeneity and plasticity in epithelia / G. Donati, F. M. Watt // Cell Stem Cell. – 2015. – Т. 16. – Р. 465–476.
74 Терских, В. В. Стволовые клетки и структура эпидермиса / В. В. Терских, А. В. Васильев, Е. А. Воротеляк // Вестник дерматологии и венерологии. – 2005. – № 3. – С. 11–15.
75 Биология стволовых клеток и клеточные технологии: В 2 т. / Под ред. М. А. Пальцева. – М.: Медицина, 2009. – 272 с.
76 Домнина, А. П. Мезенхимальные стволовые клетки эндометрия человека при длительном культивировании не подвергаются спонтанной трансформации / А. П. Домнина, И. И. Фридлянская, В. И. Земелько и др. // Цитология. – 2013. – № 55 (1). – С. 69–74.
77 Приказ Министерства здравоохранения Российской Федерации от 19.01.2017 № 14н «Об утверждении формы спецификации на биомедицинский клеточный продукт».
78 Козлов, И. Г. Биоподобные препараты: в начале проблемы / И. Г. Козлов // Consilium Medicum. – 2010. – Т. 12. – № 12. – C. 94–98.
79 Сабурина, И. Н. Сопоставление поведения стромальных клеток пупочного канатика и мультипотентных стромальных клеток взрослого костного мозга в 2-d и 3-d-культуре: моделирование стромальной регенерации / И. Н. Сабурина, А. А. Горкун, Н. В. Кошелева, М. Л. Семенова, А. А. Пулин, В. С. Репин // Вестник новых медицинских технологий. – 2009. – Vol. 16. – № 4. – P. 9–11.
80 Antoni, D. Three-dimensional cell culture: a breakthrough in vivo / D. Antoni, H. Burckel, E. Josset, G. Noel // International Journal of Molecular Sciences. – 2015. – Vol. 16. – P. 5517–5527.
81 Moscona, A. A. The dissociation and aggregation of cells from organ rudiments of the early chick embryos / A. A. Moscona, H. Moscona // Journal of Anatomy. – 1952. – Vol. 86. – P. 287–303.
82 Moscona, A. A. Tissues from dissociated cells / A. A. Moscona // Scientific American. – 1959. – Vol. 200. – P. 132–134.
83 Steinberg, M. S. Reconsttution of tissues by dissociated cells: some morphogenetic tissue movements and the sorting out of embryonic cells may have a common explanation / M. S. Steinberg // Science. – 1963. – Vol. 141. – P. 401–408.
84 Steinberg, M. S. Differential adhesion and morphogenesis: a modern view / M. S. Steinberg // Curr. Opin. Genet. Dev. – 2007. – Vol. 17. – P. 281–285.
85 Сабурина, И. Н. Зd-культивирование: от отдельных клеток к регенерационной ткани (к вопросу о феномене эпителио-мезенхимальной пластичности) / И. Н. Сабурина, B.C. Репин // Гены и клетки. – 2010. – Vol. 5. – No. 2. – P. 75–86.
86 Манагаров, Н. Г. Костная пластика в челюстно-лицевой хирургии / Н. Г. Манагаров // Здравоохранение Югры: опыт и инновации. – 2018. – № 3 (16). – С. 27.
87 Довгилева, О. М. Основные особенности репаративной регенерации кожи в условиях применения хитозана / О. М. Довгилева, Г. В. Хомулло, М. Б. Петрова // Верхневолжский медицинский журнал. – 2011. – Т. 9. – Вып. 3. – № 11. – С. 30–37.
88 Li, H. W. Emerging concepts in haematopoietic cell transplantation / H. W. Li, M. Sykes // Nat. Rev. Immunol. – 2012. – Vol. 12 (6). – P. 403–416.
89 Бабаева, А. Г. Регенерация: факты и перспективы / А. Г. Бабаева. – М. : Издательство РАМН, 2009. – 336 с.
90 Ноздрин, В. И. Гистофизиология кожи / В. И. Ноздрин, С. А. Барашкова, В. В. Семченко. – Омск, 2008. – 280 с.
91 Данилов, Р. К. Раневой процесс: гистогенетические основы / Р. К. Данилов. – СПб. : Военно-медицинская академия имени С. М. Кирова, 2008. – 380 с.
92 Fuchs, Y. ARTS Regulates Stem Cell Apoptosis and Skin Regeneration / Y. Fuchs, S. Brown, T. Gorenc et al. // Science. – 2013. – Vol. 19. – No. 341 (6143). – Р. 286–289.
93 Engel, P. CD Nomenclature 2015: Human Leukocyte Differentiation Antigen Workshops as a Driving Force in Immunology / P. Engel et al. // J. Immunol. – 2015. – Т. 195 (10). – Р. 4555–4563.
94 Nery, A. A. Human Mesenchymal Stem Cells: From Immunophenotyping by Flow Cytometry to Clinical Applications / A. A. Nery, I. C. Nascimento, T. Glaser et al. // Cytometry. – 2013. – No. 83A. – Р. 48–61.
95 Donati, G. Stem cell heterogeneity and plasticity in epithelia / G. Donati, F. M. Watt // Cell Stem Cell. – 2015. – Т. 16. – Р. 465–476.
96 Козлов, И. Г. Биоподобные препараты: в начале проблемы / И. Г. Козлов // Consilium Medicum. – 2010. – Т. 12. – № 12. – C. 94–98.
97 Gibson, T. Zoografting – A curious chapter in the history of plastic surgery / T. Gibson // Br. J. of Plast. Surg. – 1955. – Vol. 8. – P. 234–242.
98 Prochorov, A. V. Long–term normalization of diabetes mellitus after xenotransplantation of fetal pancreatic islet cells into the blood stream without immunosuppressive therapy / A. V. Prochorov et al. // Transplantation Proceedings. – 2004. – Vol. 36. – P. 2855–2856.
99 Хрыщанович, В. Я. Ксеногенная клеточная терапия: современное состояние проблемы и перспективы свиной клеточной трансплантации / В. Я. Хрыщанович, С. И. Третьяк, А. А. Глинник // Журнал ГрГМУ. – 2012. – № 1 (37). – С. 14–23.
100 Fisher, M. B. Tissue engineering and regenerative medicine: recent innovations and the transition to translation / M. B. Fisher, R. L. Mauck // Tissue. Eng. Part B. Rev. – 2013. – V. 19. – No. 1. – P. 1–13.
101 Uludag, H. At the Intersection of Biomaterials and Gene Therapy: Progress in Non-viral Delivery of Nucleic Acids / H. Uludag, A. Ubeda, A. Ansari // Front Bioeng. Biotechnol. – 2019. – Т. 7. – Р. 131.
102 Fuchs, Y. ARTS Regulates Stem Cell Apoptosis and Skin Regeneration / Y. Fuchs, S. Brown, T. Gorenc et al. // Science. – 2013. – Vol. 19. – No. 341 (6143). – Р. 286–289.
103 Chang, S. E. Sphingosine may have cytotoxic effects via apoptosis on the growth of keloid fibroblasts / S. E. Chang, K. J. Kim, K. H. Ro // Journal of Dermatology. – 2004. – Vol. 31. – P. 1–5.
104 Herrmann, M. A rapid and simple method for the isolation of apoptotic DNA fragments / M. Herrmann, H.-M. Lorenz, R. Voll, M. Grunke, W. Woith, J. R. Kalde // Nucleic Acids Research. – 1994. – Vol. 22. –P. 5506–5507.
105 Sato, J. D. Media for culture of mammalian cells / J. D. Sato, M. Kan // Current Protocols in Cell Biology. –2001. – Vol. 1. – P. 12–15.
106 Zheng, X. Proteomic analysis for the assessment of different lots of fetal bovine serum as a raw material for cell culture. Part IV. Application of proteomics to the manufacture of biological drugs / X. Zheng, H. Baker, W. S. Hancock, F. Fawaz, M. McCaman, E. Pungor // Biotechnology progress. – 2006. – Vol. 22. – No 5. – P. 1294–1300.
107 Надеев, А. Д. Индукция апоптоза и некроза клеток эндотелия пупочной вены человека пероксидом водорода / А. Д. Надеев, И. В. Кудрявцев, М. К. Серебрякова и др. // Цитология. – 2015. – Т. 57. – № 12. – С. 909–916.
108 Tallarida, R. J. Drug synergism and dose-effect data analysis / R. J. Tallarida. – CRC Press, 2000. – 264 p.
109 Khuri, A. I. Response surface methodology / A. I. Khuri, S. Mukhopadhyay // Wiley Interdisciplinary Reviews: Computational Statistics. – 2010. – Т. 2. – No. 2. – Р. 128–149.
110 Костоломова, Е. Г. Некоторые иммунофизиологические механизмы регенерации ран в условиях применения ранозаживляющего средства Cellgel / Е. Г. Костоломова, Ю. Г. Суховей, С. В. Гольцов и др. // Российский иммунологический журнал. – 2016. – № 10 (19). – С. 289–291.
111 Гистологическая техника : учеб. пособие / под ред. В. В. Семченко, С. А. Барашкова, В. Н. Ноздрина и др. – Омск; Орел : Омская областная типография, 2006. – 290 с.
112 Попова, Л. Н. Как изменяются границы вновь образующегося эпидермиса при заживлении ран : автореф. дис. … канд. мед. наук / Л. Н. Попова. – М., 1942. – 16 с.
113 Шарафутдинова, И. Р. Инновационные технологии в мониторинге скорости заживления ран / И. Р. Шарафутдинова, З. З. Мустафина, А. Я. Габитова и др. // Международный студенческий научный вестник. – 2018. – № 4. – Ч. 1. – С. 177–179.
114 Патент № 2481115 Российская Федерация, Средство для заживления ран «Cellgel», способ его получения и способ лечения ран различной этиологии полученным средством / С. В. Гольцов, Ю. Г. Суховей, Е. Г. Костоломова и др.; патентообладатель Гольцов С. В. – № 2011141622/15 заявл. 13.10.2011; опубл. 10.05.2013, Бюл. № 13.
115 Гольцов, С. В. Cellgel – новое слово в ранозаживлении / С. В. Гольцов, Е. Н. Гольцова, А. Д. Гетьман и др. // Дерматология в России. – 2017. – № 1. – С. 28–33.
116 Костоломова, Е. Г. Некоторые иммунофизиологические механизмы регенерации ран в условиях применения ранозаживляющего средства Cellgel / Е. Г. Костоломова, Ю. Г. Суховей, С. В. Гольцов и др. // Российский иммунологический журнал. – 2016. – № 10 (19). – С. 289–291.
117 Костоломова, Е. Г. Роль процессов пролиферации и апоптоза в образовании рубцовой ткани / Е. Г. Костоломова, С. А. Стрелин, Ю. Г. Суховей и др. // Медицинская иммунология. – 2017. – № 19 (5). – С. 327.
118 Костоломова, Е. Г. Взаимодействие иммуноцитов кожи в процессе репаративной регенерации в ране / Е. Г. Костоломова, Ю. Г. Суховей, И. Г. Унгер и др. // Российский иммунологический журнал. – 2017. – № 2 (20). – С. 148–150.
119 Суховей, Ю. Г. Регенераторно-репаративные и антибактериальные свойства препарата Cellgel в эксперименте / Ю. Г. Суховей, Е. Г. Костоломова, С. Б. Цирятьева и др. // Российский иммунологический журнал. – 2015. – № 9 (2). – С. 44.
120 Патент № 159463 Российская Федерация, Устройство для активации репаративных потенций клеток кожи / С. В. Гольцов, Ю. Г. Суховей, Е. Г. Костоломова и др.; патентообладатель Гольцов С. В. – № 2015131577/10; заявл. 29.07.2015; опубл. 10.02.2016, Бюл. № 4.
121 Петрова, Н. П. Система независимой оценки (подтверждения) соответствия парфюмерно-косметической продукции в Российской Федерации / Н. П. Петрова, А. В. Резайкина, С. В. Ротанов // Вестник дерматологии и венерологии. – 2015. – № 6. – С. 90–96.
122 Кубанова, А. А. Перспективы практического использования наночастиц в дерматологии / А. А. Кубанова, С. Р. Утц, А. А. Кубанов и др. // Вестник дерматологии и венерологии. – 2016. – № 2. – С. 15–20.
123 Тараховский, Ю. С. Интеллектуальные липидные наноконтейнеры в адресной доставке лекарственных веществ / Ю. С. Тараховский. – М. : ЛКИ, 2011. – 280 с.
124 Papakostas, D. Nanoparticles in dermatology / D. Papakostas, F. Rancan, W. Sterry et al. // Archives of Dermatological Research. – 2011. – Т. 303. – Р. 533–550.
125 Воротеляк, Е. А. Организация популяции кератиноцитов в культуре in vitro / Е. А. Воротеляк, Э. С. Чермных, А. В. Васильев и др. // Известия РАН. Сер. биол. – 2005. – № 6. – С. 645–649.
126 Костоломова, Е. Г. Некоторые иммунофизиологические механизмы регенерации ран в условиях применения ранозаживляющего средства Cellgel / Е. Г. Костоломова, Ю. Г. Суховей, С. В. Гольцов и др. // Российский иммунологический журнал. – 2016. – № 10 (19). – С. 289–291.
127 Воротеляк, Е.А. Регенерация кожи: очевидные модели и неочевидные результаты / Е. А. Воротеляк, Е. И. Моргун, Э. С. Чермных, О. С. Роговая, Е. П. Калабушева // Гены и клетки. – 2022. – Т. 17. – № 3. – С. 47–47.
к предыдущей странице | читать далее | сразу к следующей главе