Результаты
В контрольных образцах клеток линии ТНР-1 относительно содержание живых клеток составляло 96,53±0,46%. Внесение вещества в финальной концентрации 350 мкг/мл сопровождалось достоверным снижение (р<0,001) относительного содержания жизнеспособных клеток до 91,72±0,44%. Более того, отмечено достоверное увеличени относительного содержания клеток, находящихся на ранних стадиях апоптоза (3,16±0,19% против 1,99±0,39% в контроле, р=0,024), а также погибших клеток (поздний апоптоз/некроз), когда результаты контрольных образов были превышение более чем в 4 раза (5,12±0,28% и 1,47±0,21%, соответственно, при р<0,001). Что касается серии экспериментов, в рамках которых веществот применятся в финальной концентрации 70 мкл, то было отмечено достоверное двукратное увеличение (р=0,009) клеток, находящихся на терминальных стадиях апоптоза и в некрозе (2,69±0,29%). Препарат в финальной концентрации 7 мкг/мл не оказывал достоверное влияние ни на один из исследованных показателей (рисунок 1., рисунок2.)
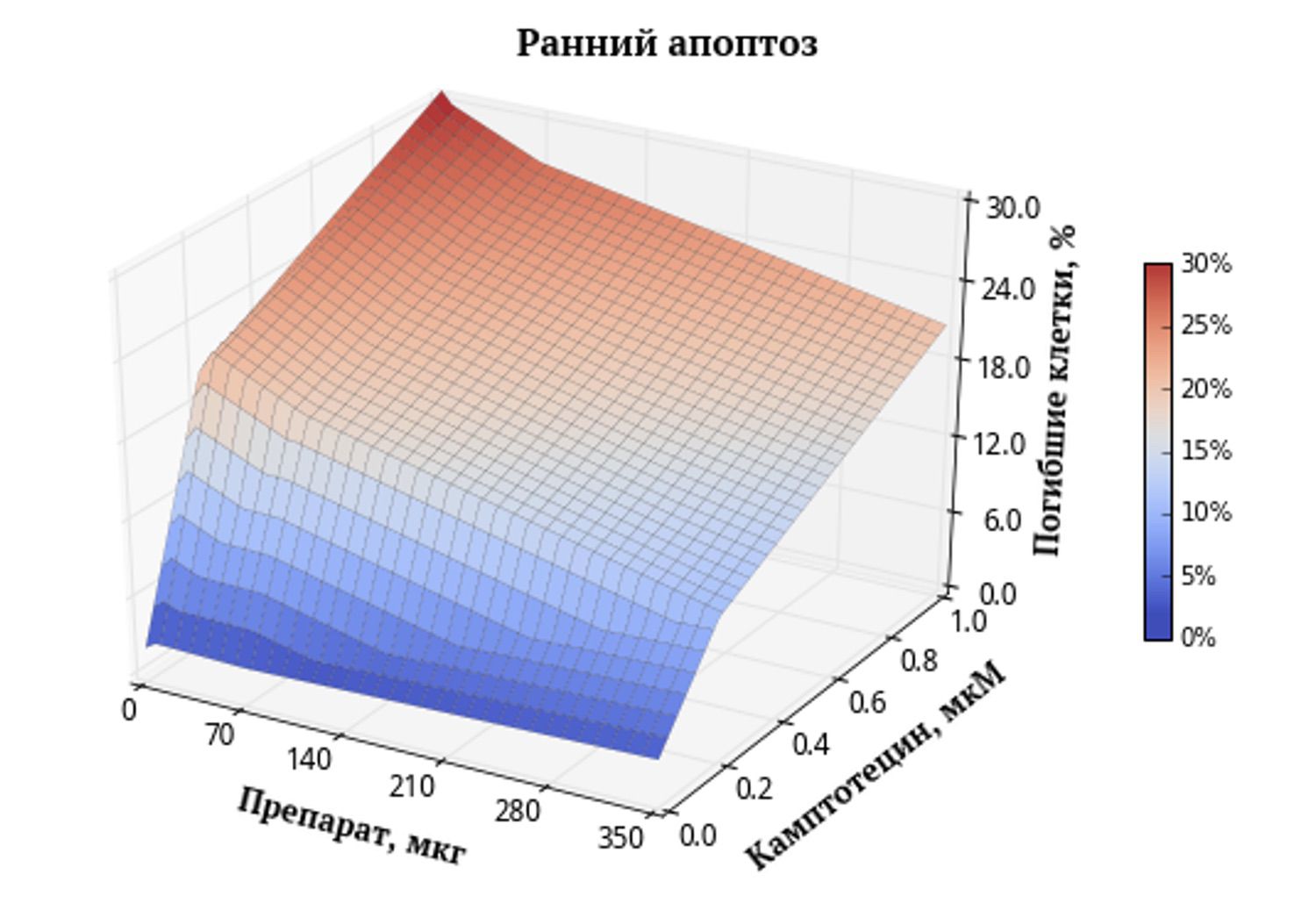
Рис. 1. Поверхность, характеризующая зависимость ранней апоптической гибели клеток от концентраций веществ. Градиентная заливка поверхности позволяет оценивать отдельное и комбинированное действие препарата и камптотецина. Синим цветом обозначены области с низким процентом гибели клеток, а красным – области с высоким процентом гибели.
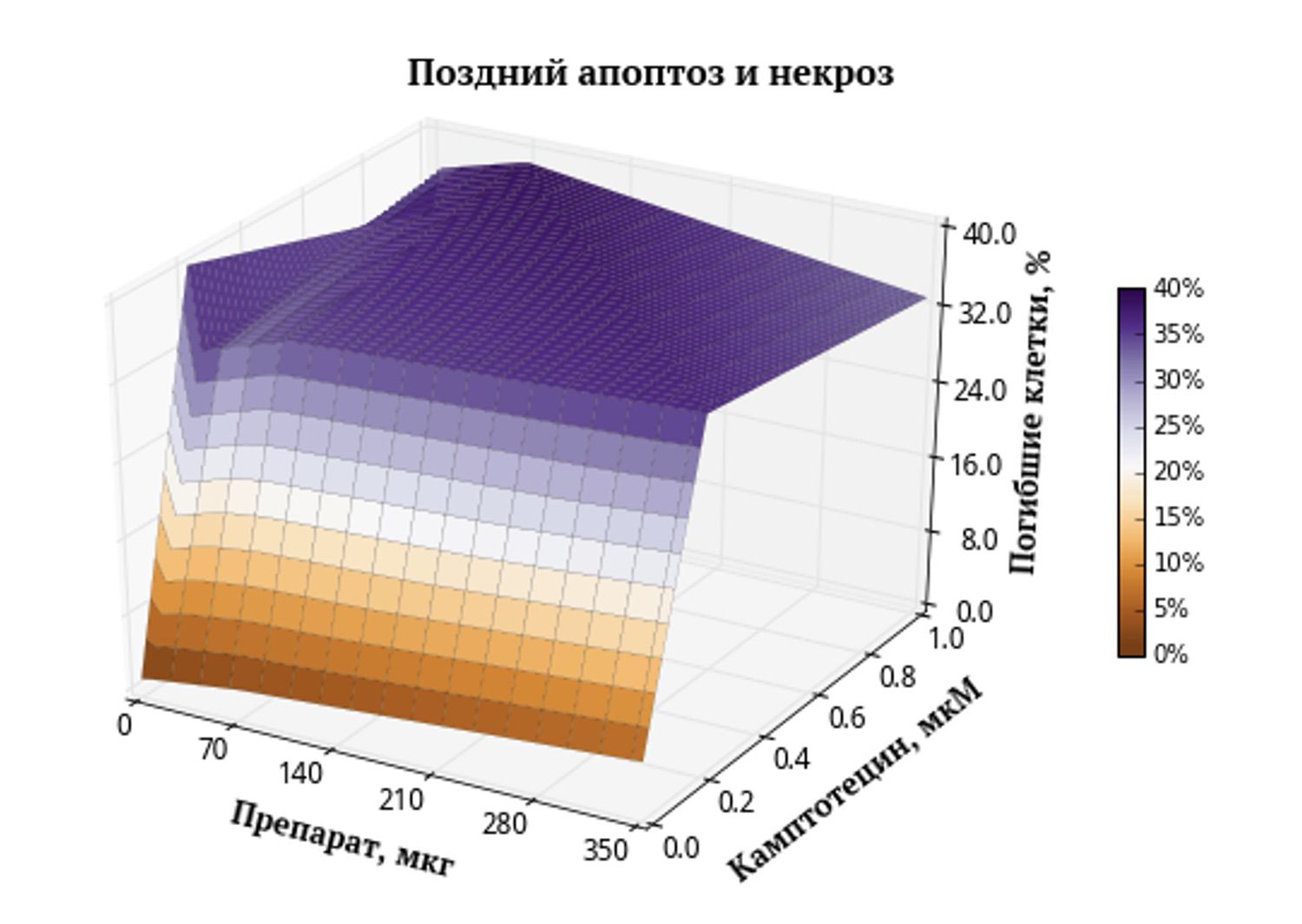
Рис. 2. Поверхность, характеризующая зависимость поздней гибели клеток в результате апоптоза и некроза от концентраций веществ. Коричневым цветом обозначены области с низким процентом гибели клеток, а фиолетовым – области с высоким процентом гибели.
Внесение в среду для культивирования камптотецина, индуктора апоптоза, в финальной концентрации 1 мкМ сопровождалось снижением (р<0,001) относительного содержания жизнеспособных клеток до 31,58±1,68%, а также увеличением относительного содержания клеток на ранних и поздних стадиях апоптоза (до 30,12±1,94% и 38,30%, соответственно). Вместе с тем, в присутствие препарата в финальной концентрации 350 мкг/мл уровень жизнеспособных клеток увеличивался (р=0,001) и достигал значений в 45,11±2,17%. Более того, относительное содержание ТНР-1, находящихся на ранних стадия апоптоза снижалось до 21,49±2,15% (р=0,018), а клеток, находящихся на стадии позднего поптоза и некроза – до 33,40±2,49% (р=0,165). Внесение препарата в концентрациях 70 и 7 мкл/мл не оказывало достоверного влияния на распределение клеток по фазам апоптоза (рисунок 1., рисунок2.). В рамках отдельного эксперимента концентрация камптотецина в клетки была понижена до 0,2 мкМ, что привело к увеличению относительного содержания живых клеток до 47,76±3,17%, тогда как на ранних и поздних стадиях апоптоза находилось уже 20,75±2,40% и 31,49±1,31% клеток, соответственно. Инкубация ТНР-1 в присутствие камптотецина и препарата в финальной концентрации 350 мкг/мл достоверно не влияла на жизнеспособность клеток (51,11±1,49%, р=0,367), однако сопровождалась почти двукратным снижением относительного содержания клеток, находящихся на ранних стадиях апоптоза (до 12,86±2,00 при р=0,036). По остальным концентрациям препарата достоверных изменений жизнеспособности клеток линии ТНР-1 отмечено не было.