
Глядя в глаза этой предводительницы племени короваев, до сих пор считающихся каннибалами, думается, что конечно будут и ещё впечатления в жизни, однако шок не отпускает до сих пор! Далее...




Так, в 2011 году было изобретено ранозаживляющее средство Cellgel (ЦЕЛЬГЕЛЬ), ставшее результатом многолетних исследований и экспериментов.

Согласно записи в Государственный реестр РФ, в 2011 году был зарегистрирован Патент на изобретение RU 2481115 C1 «Средство для заживления ран «ЦЕЛЬГЕЛЬ», способ его получения и способ лечения ран различной этиологии полученным средством», на основании государственной регистрации договора исключительного права: РД0191200 единственным патентообладателем является Гольцов С.В. Исключительное право на товарные знаки на русском RU 525938 и английском RU 2016718137 языках принадлежит Гольцову С.В.

Искусственно повышая концентрацию сигнальных молекул на поверхности раны, удаётся стимулировать рост грануляционной ткани быстрее, чем фибробласты вырабатывают коллаген. А наличие биополимерной пленки удерживающей экспозицию этих молекул в ране (выполняя роль струпа), только усиливает эффективность применения ранозаживляющего средства Cellgel (ЦЕЛЬГЕЛЬ).


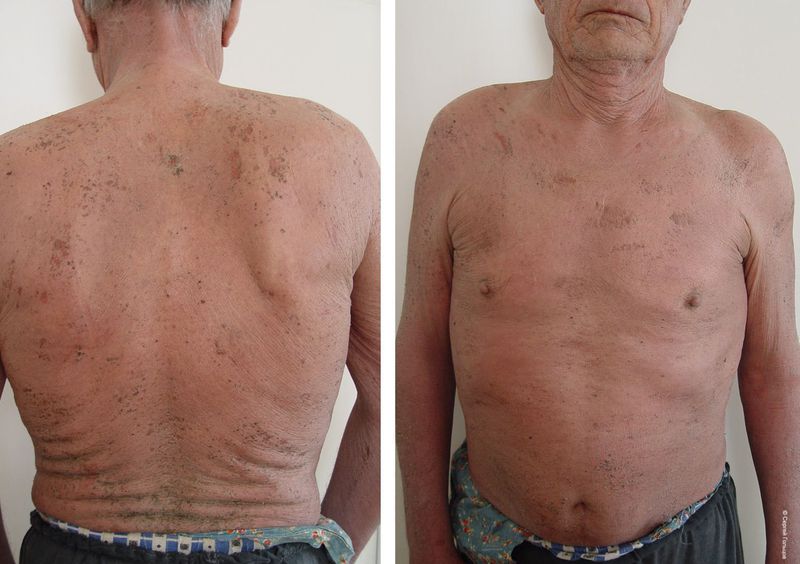
Эффективность подтверждается рядом примеров использования Cellgel (ЦЕЛЬГЕЛЬ) при заживлении ран различной этиологии.
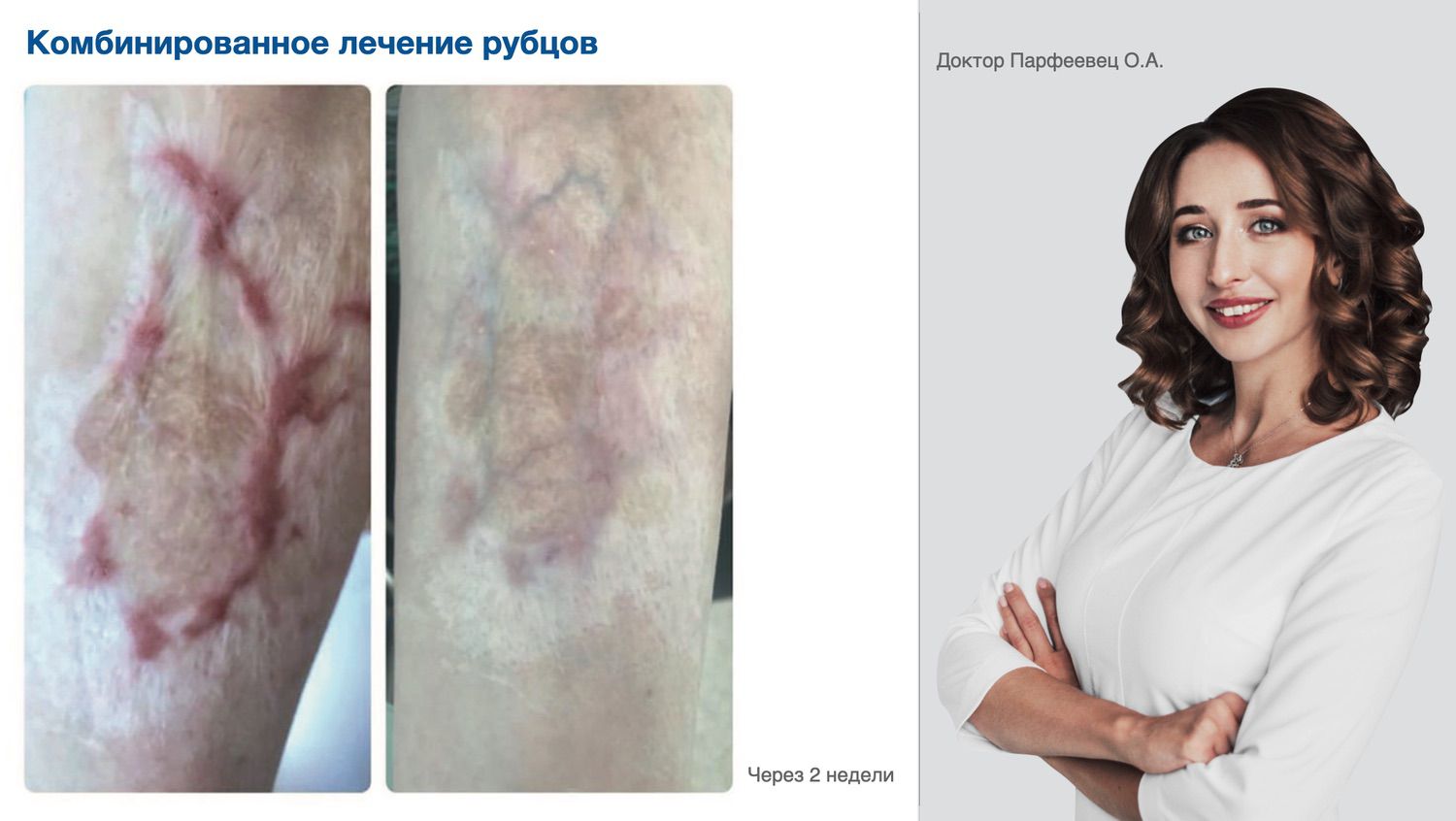
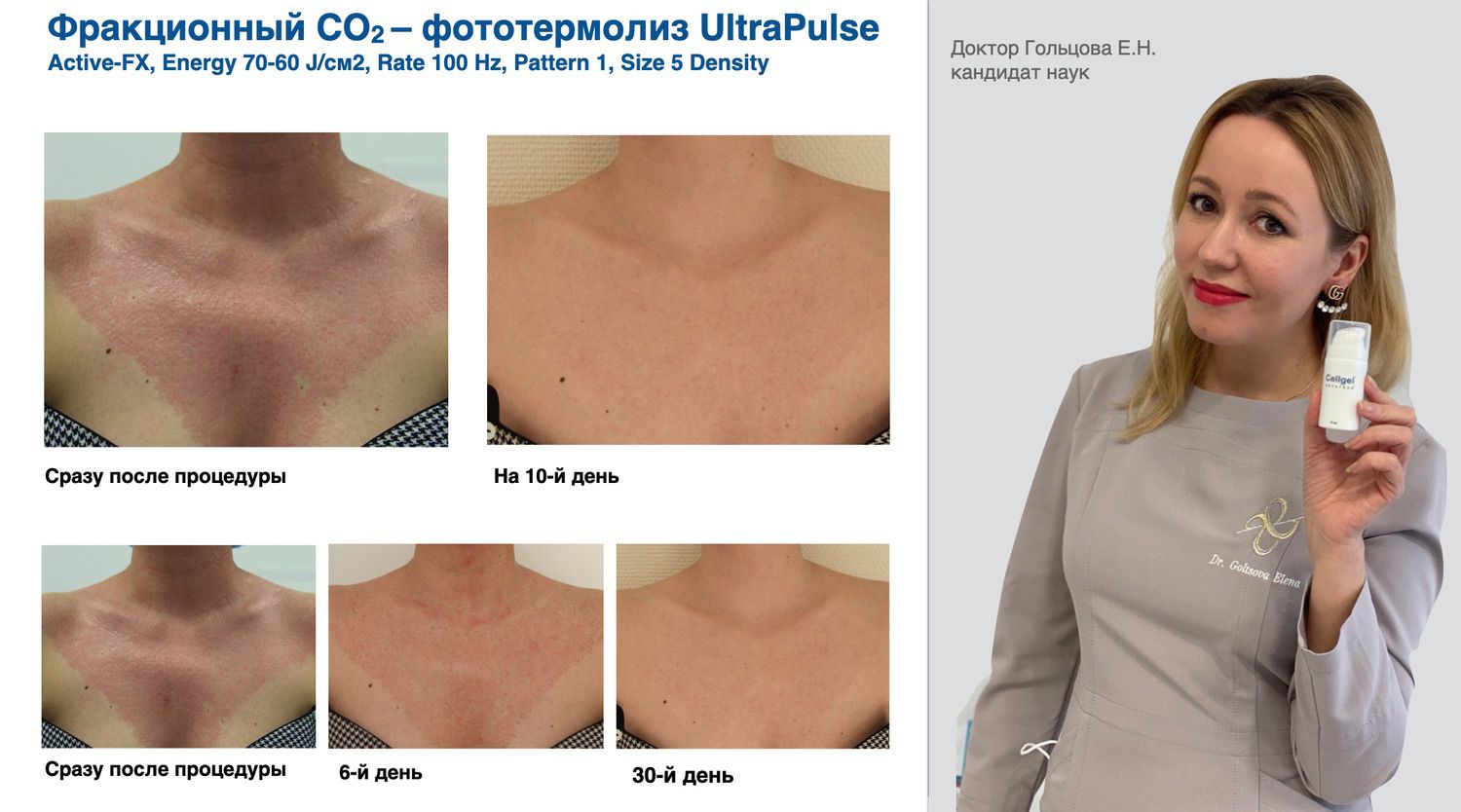
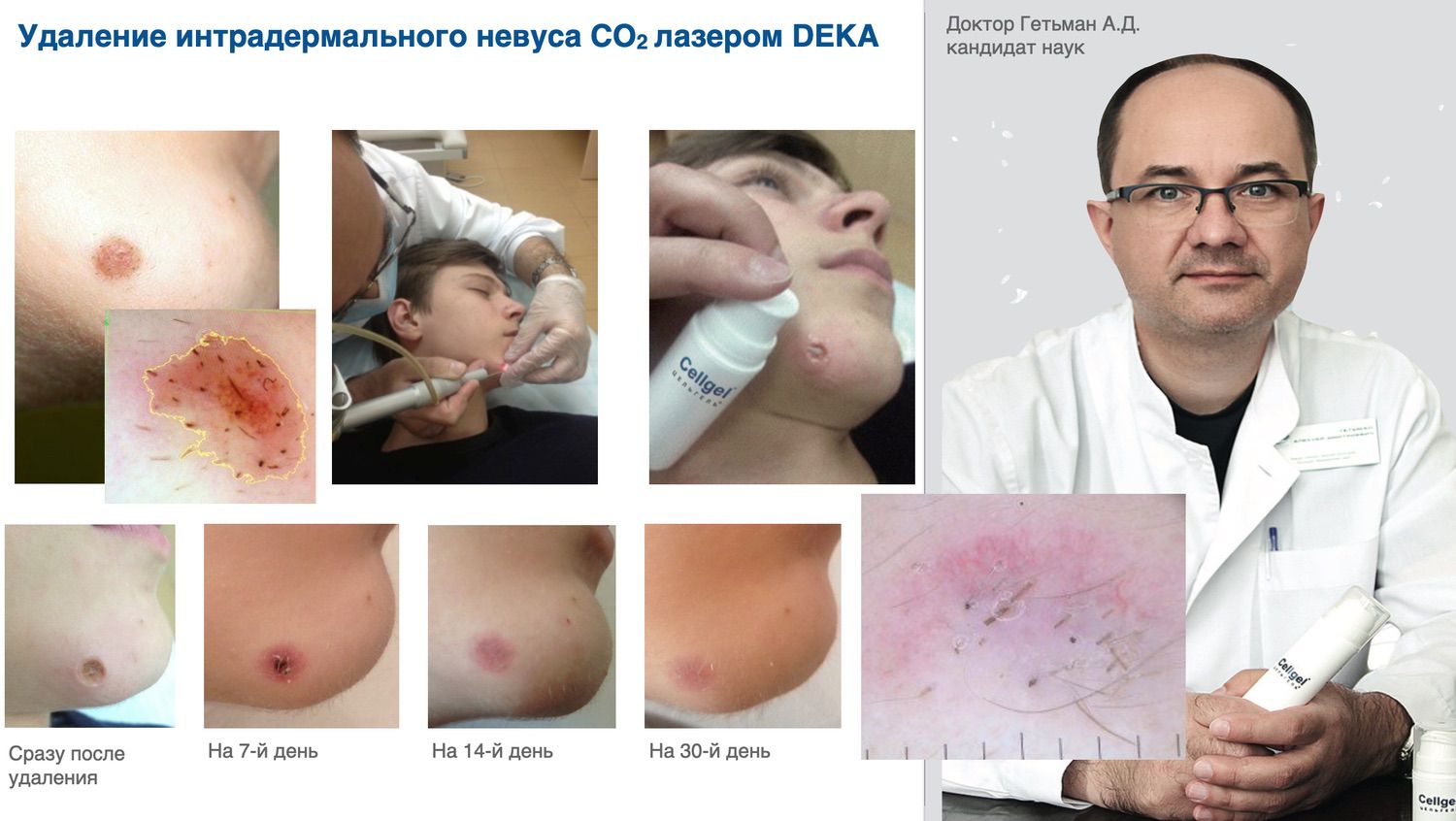
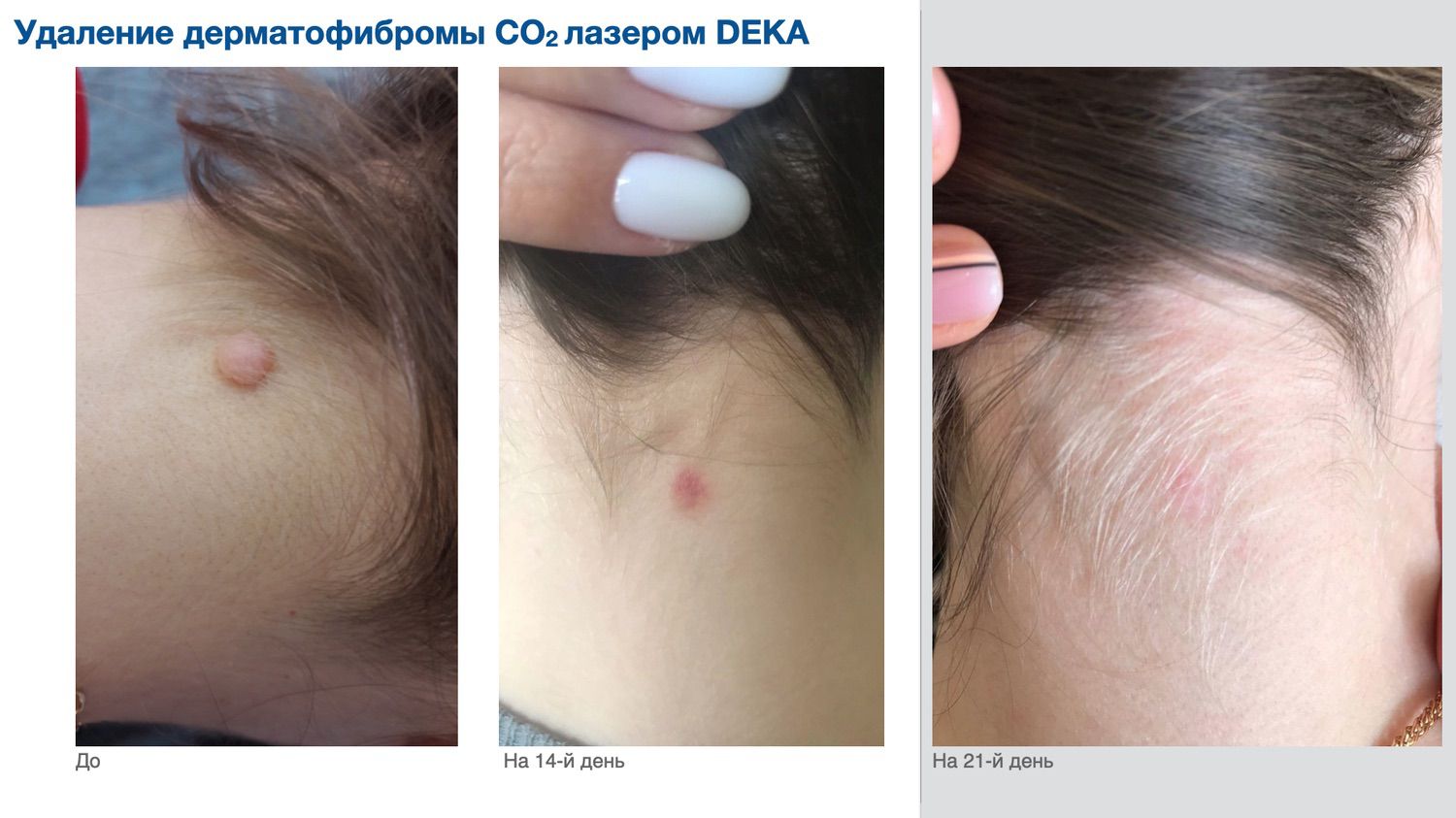
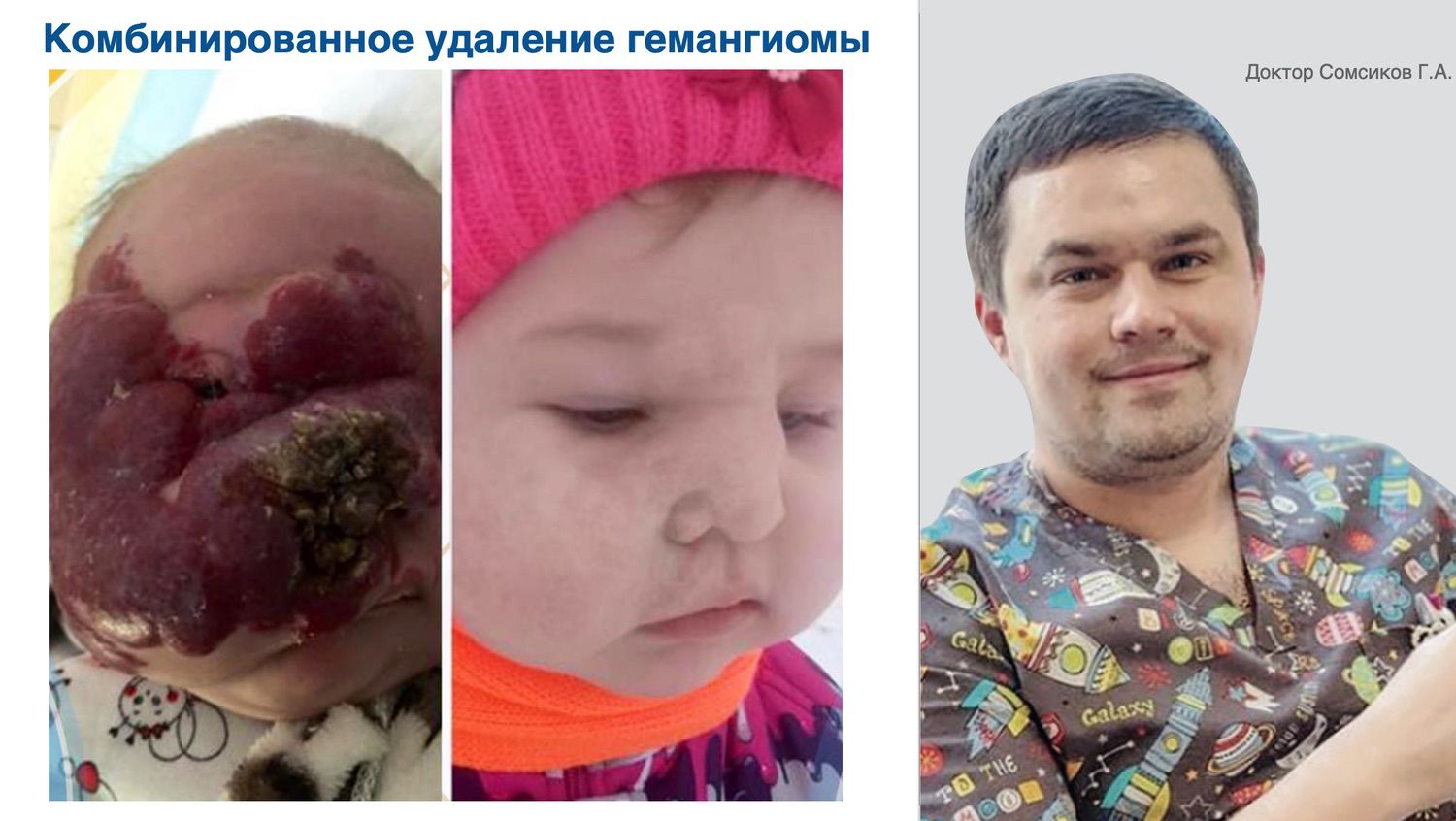
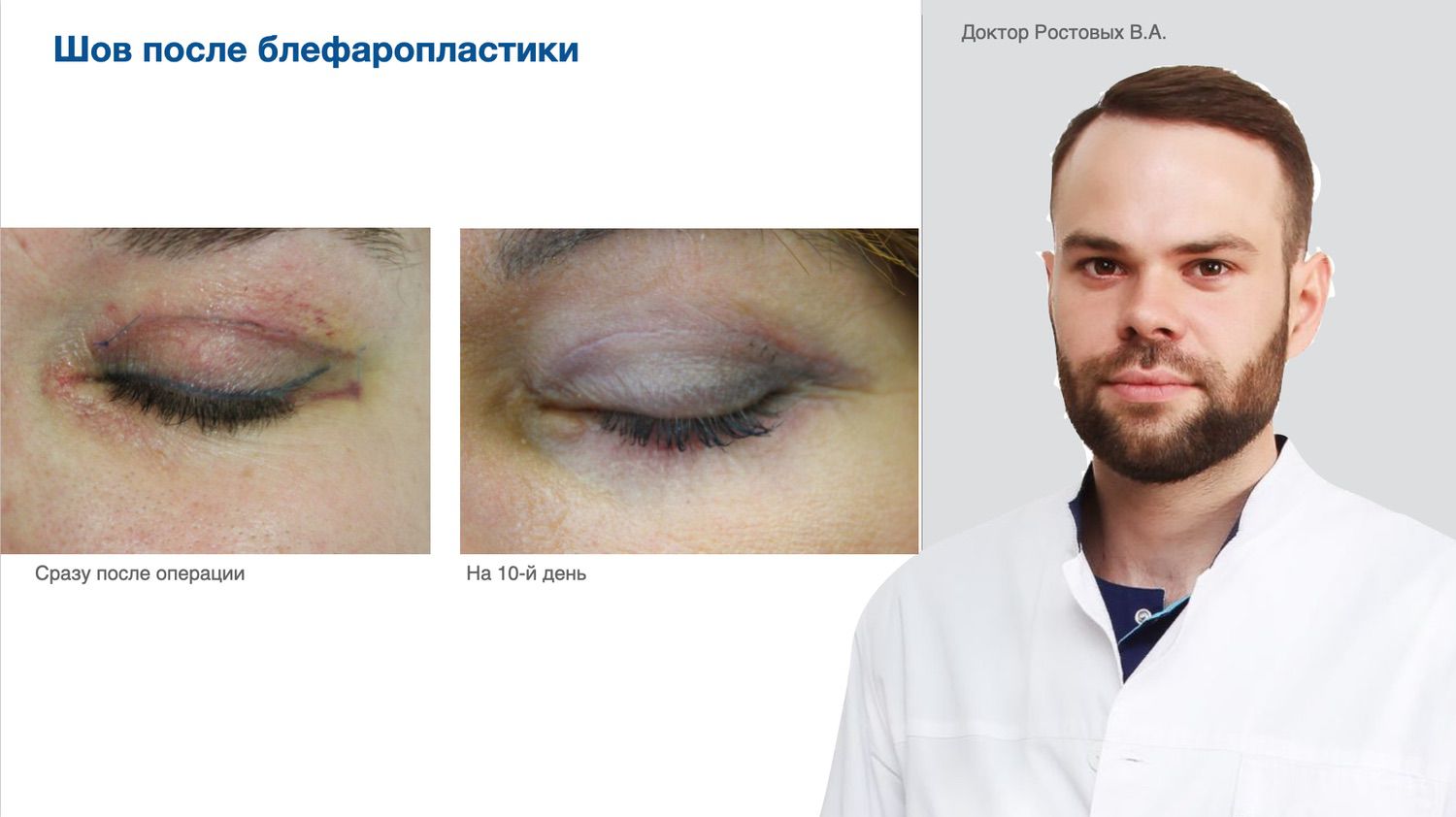
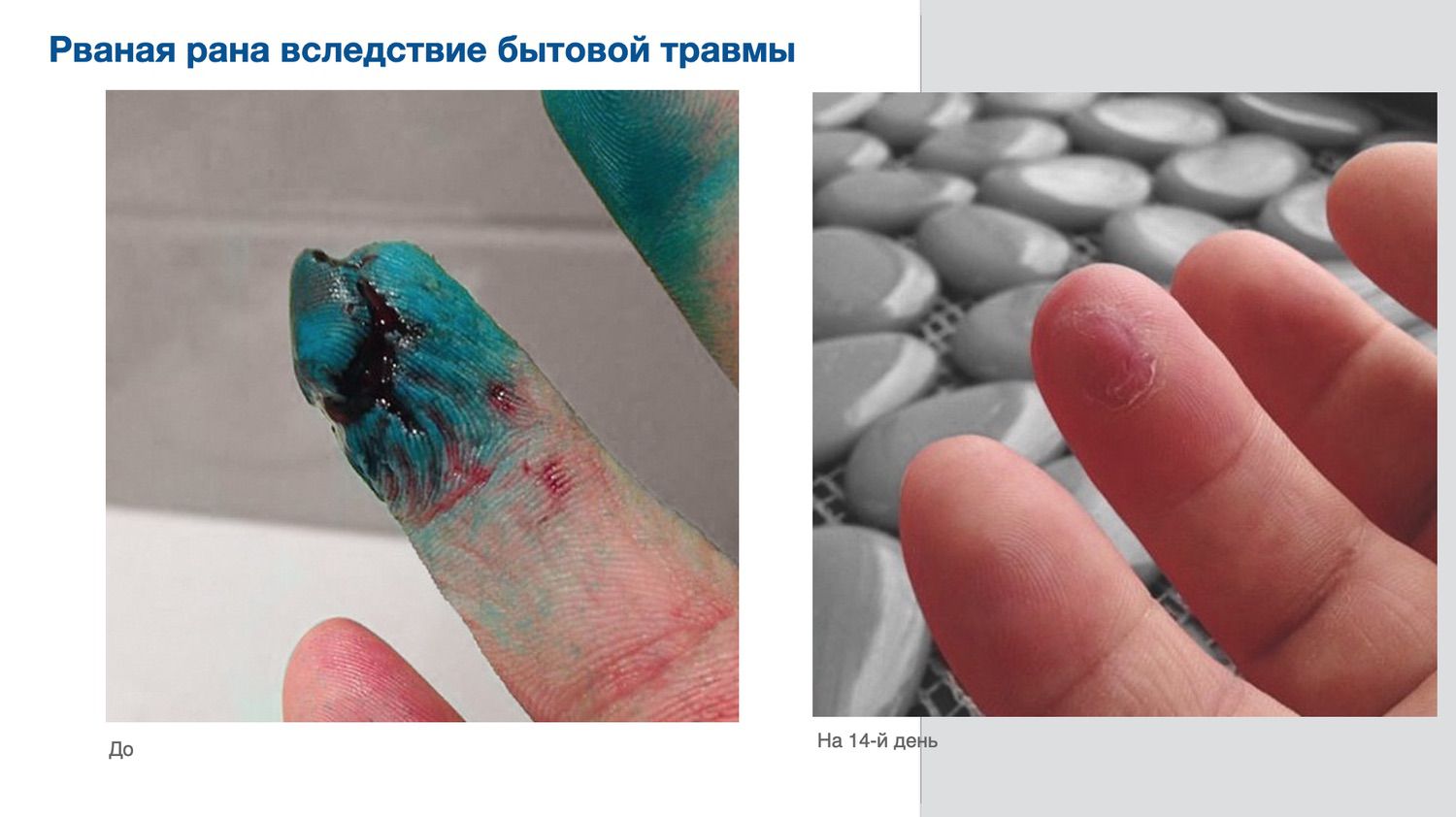
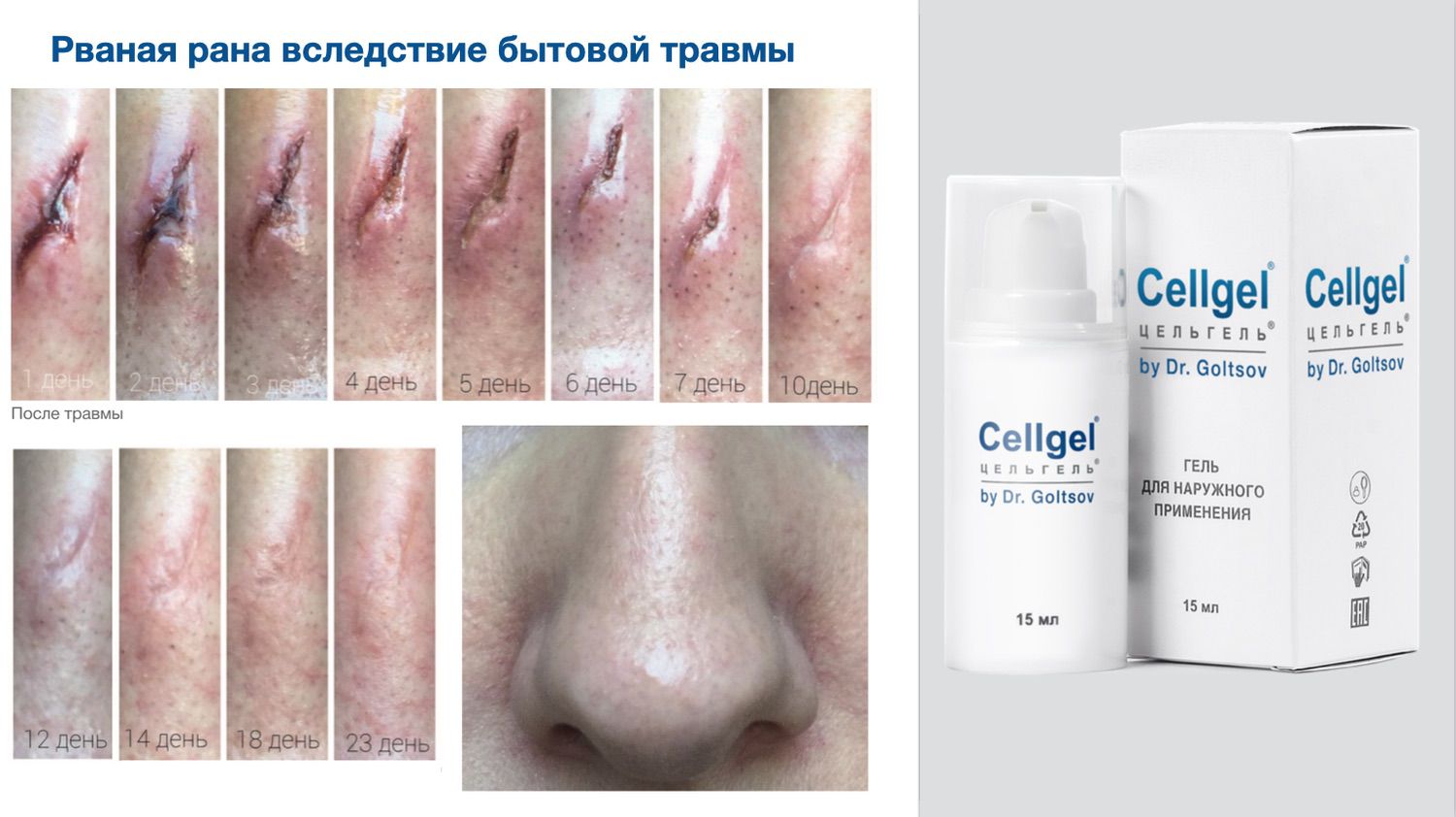
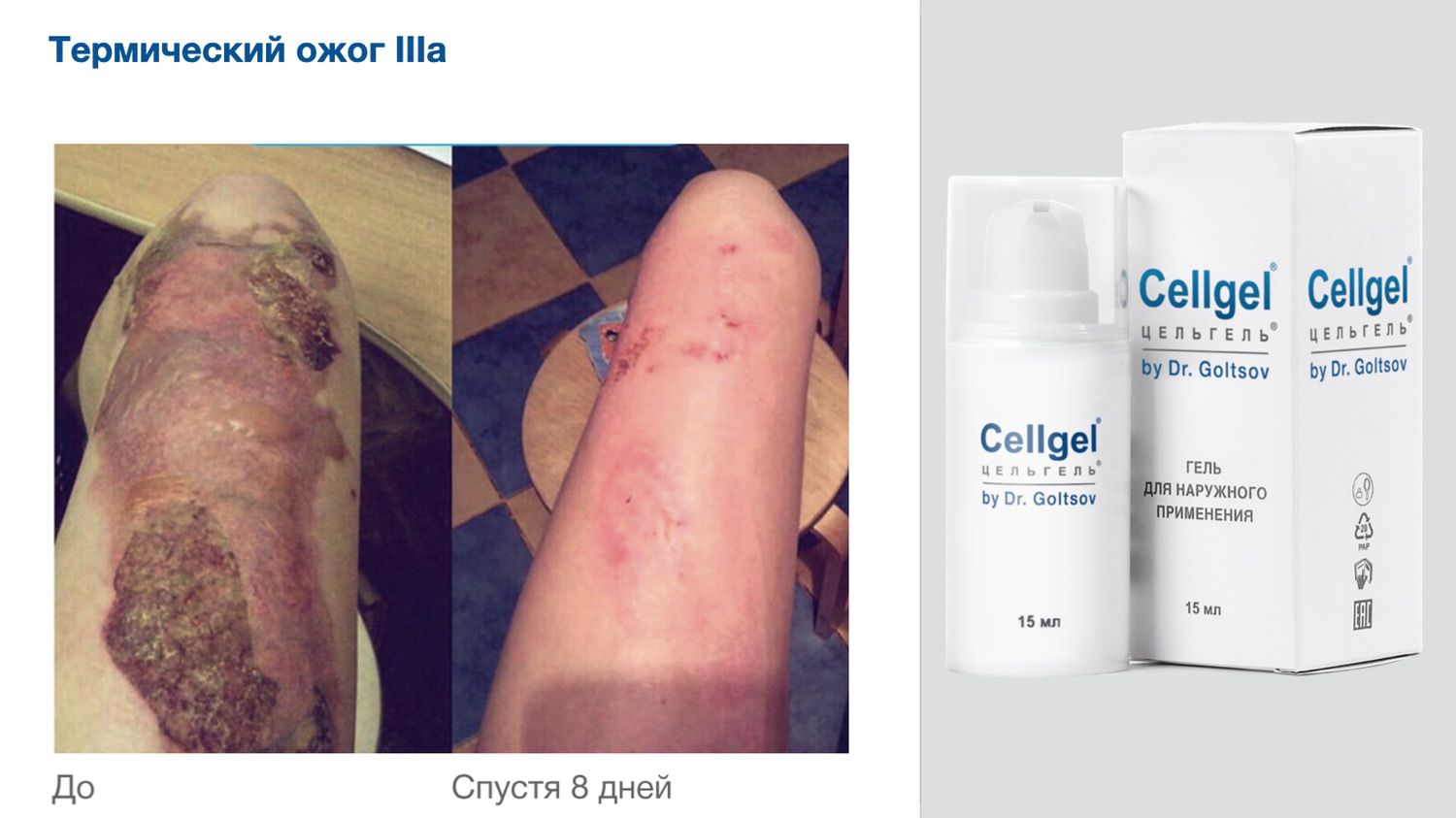
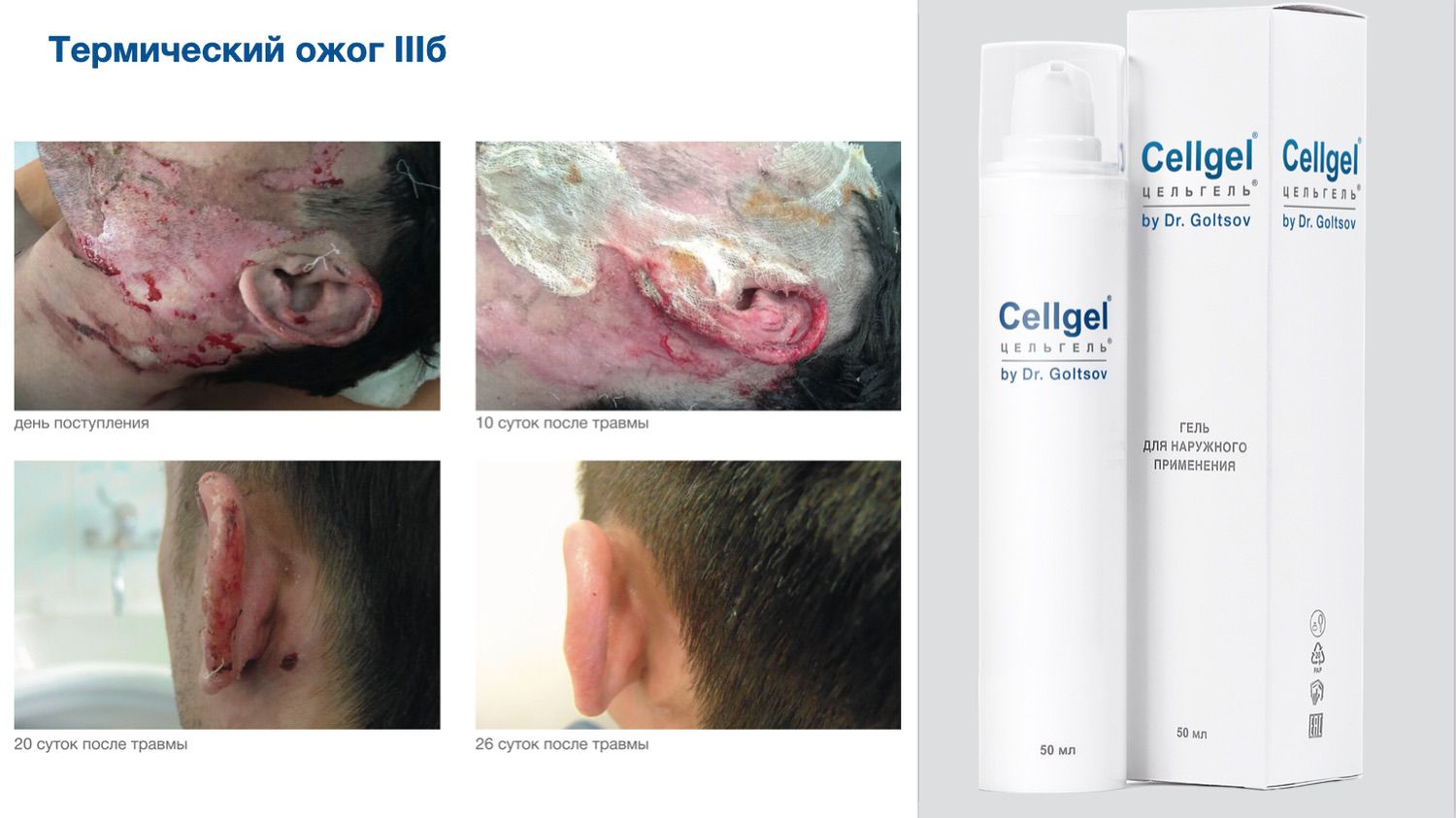
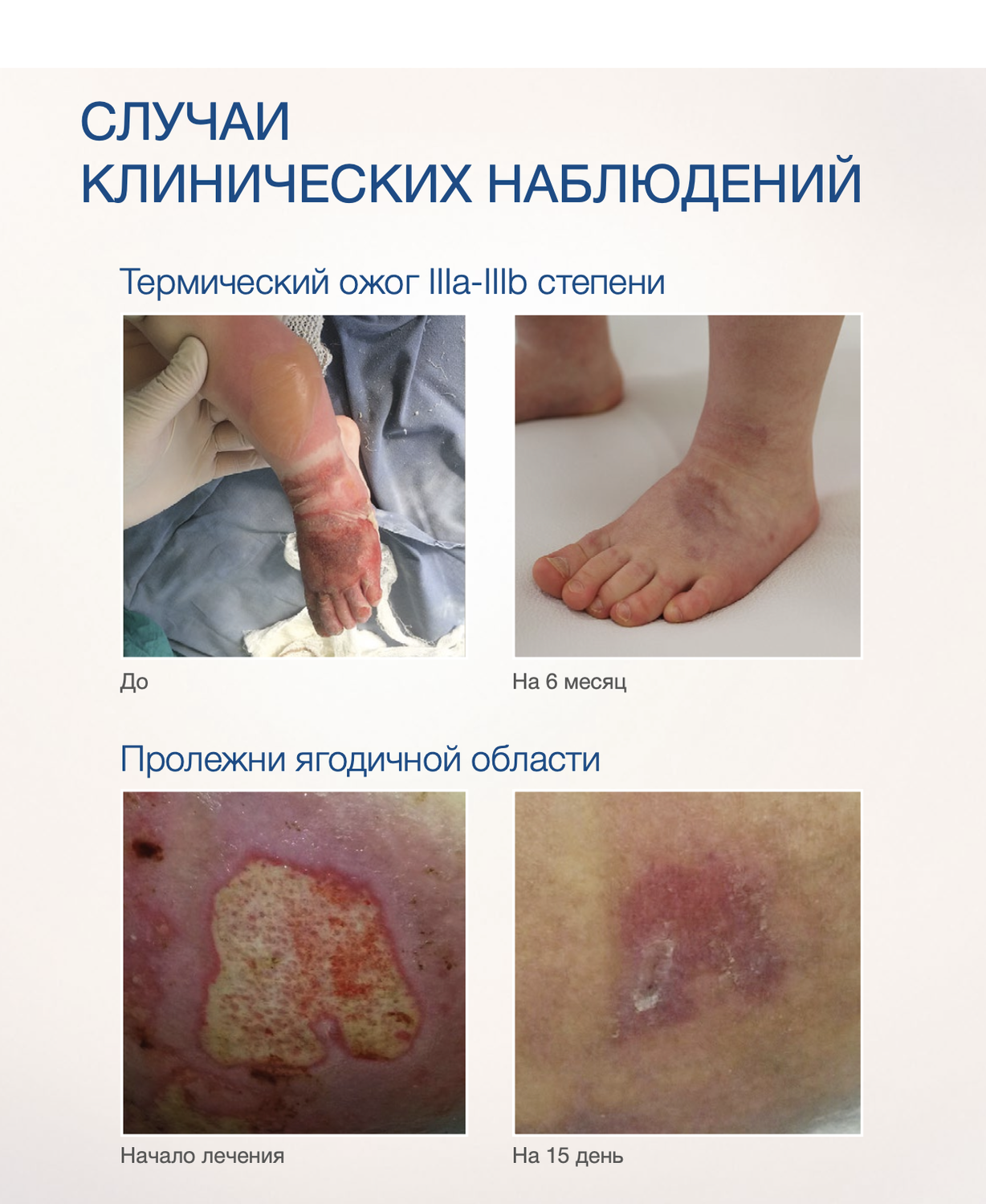
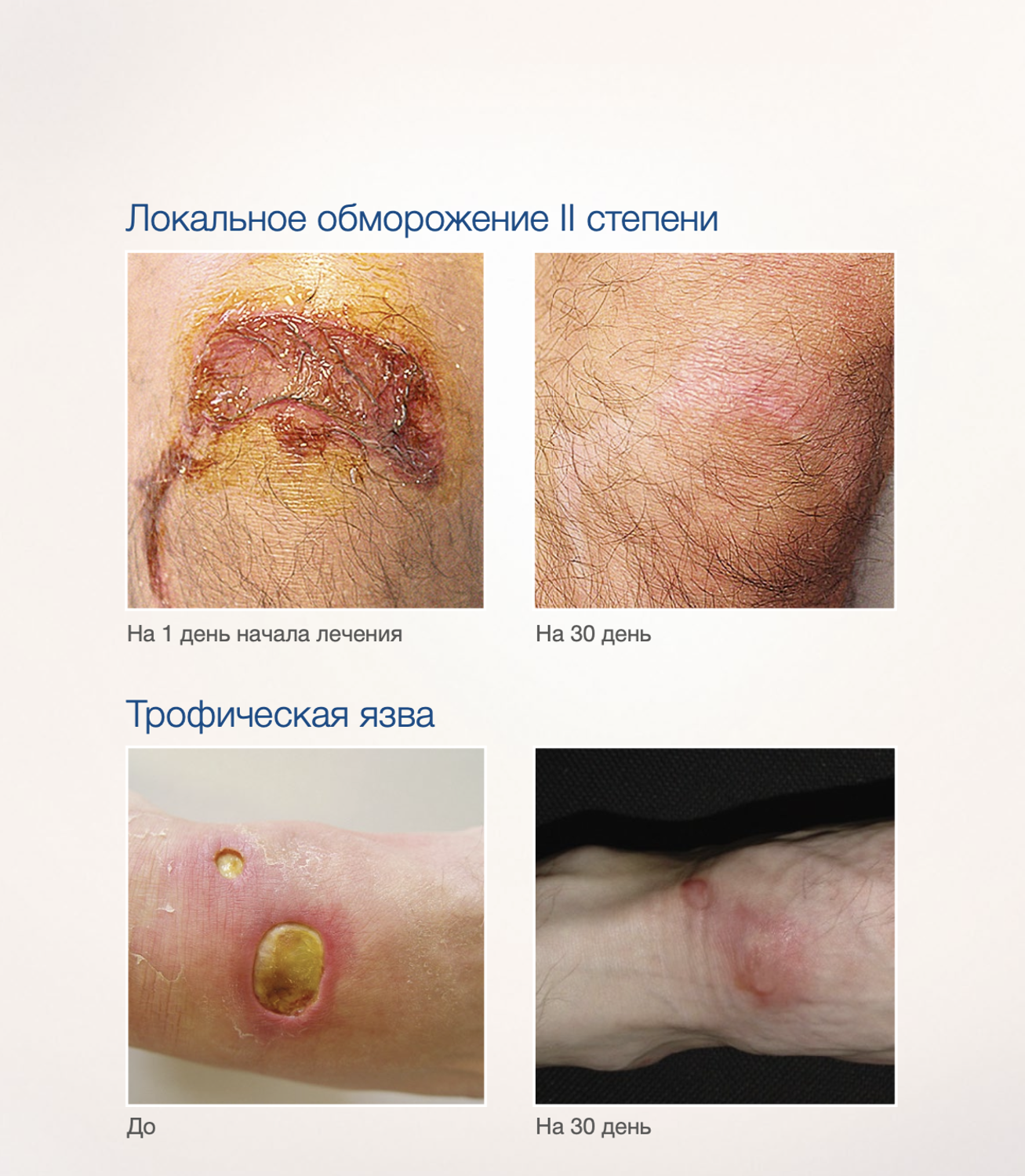
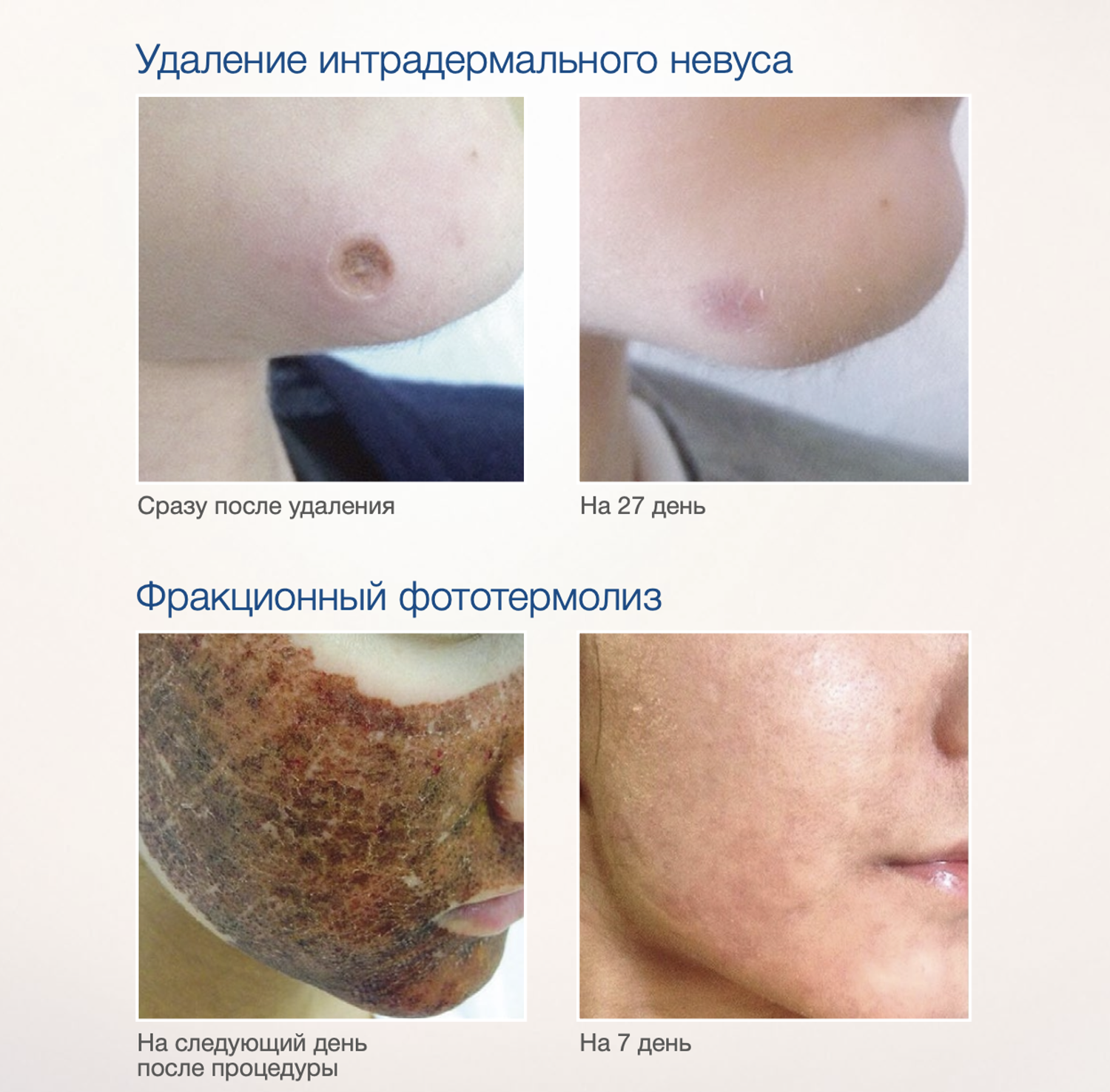
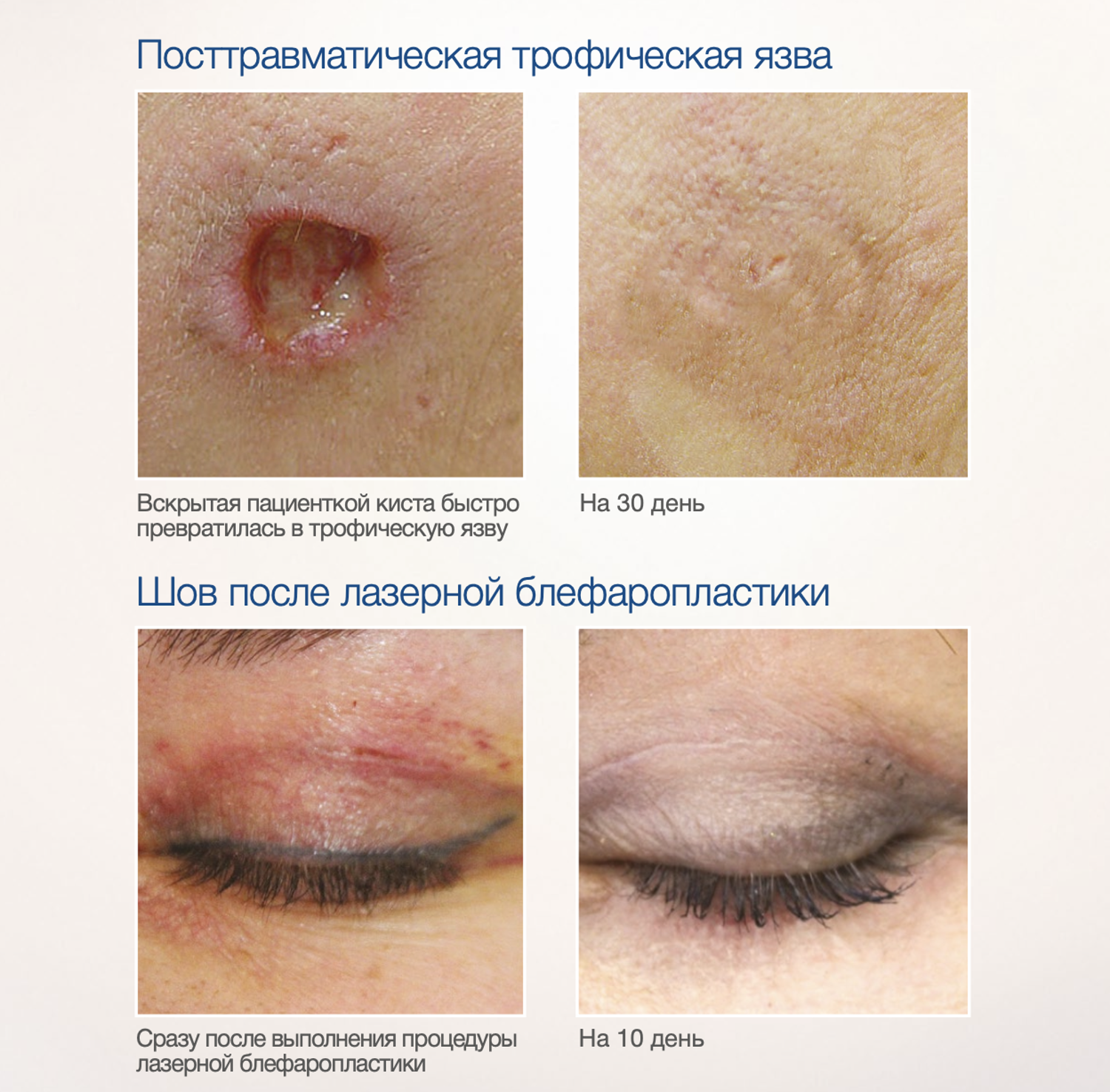
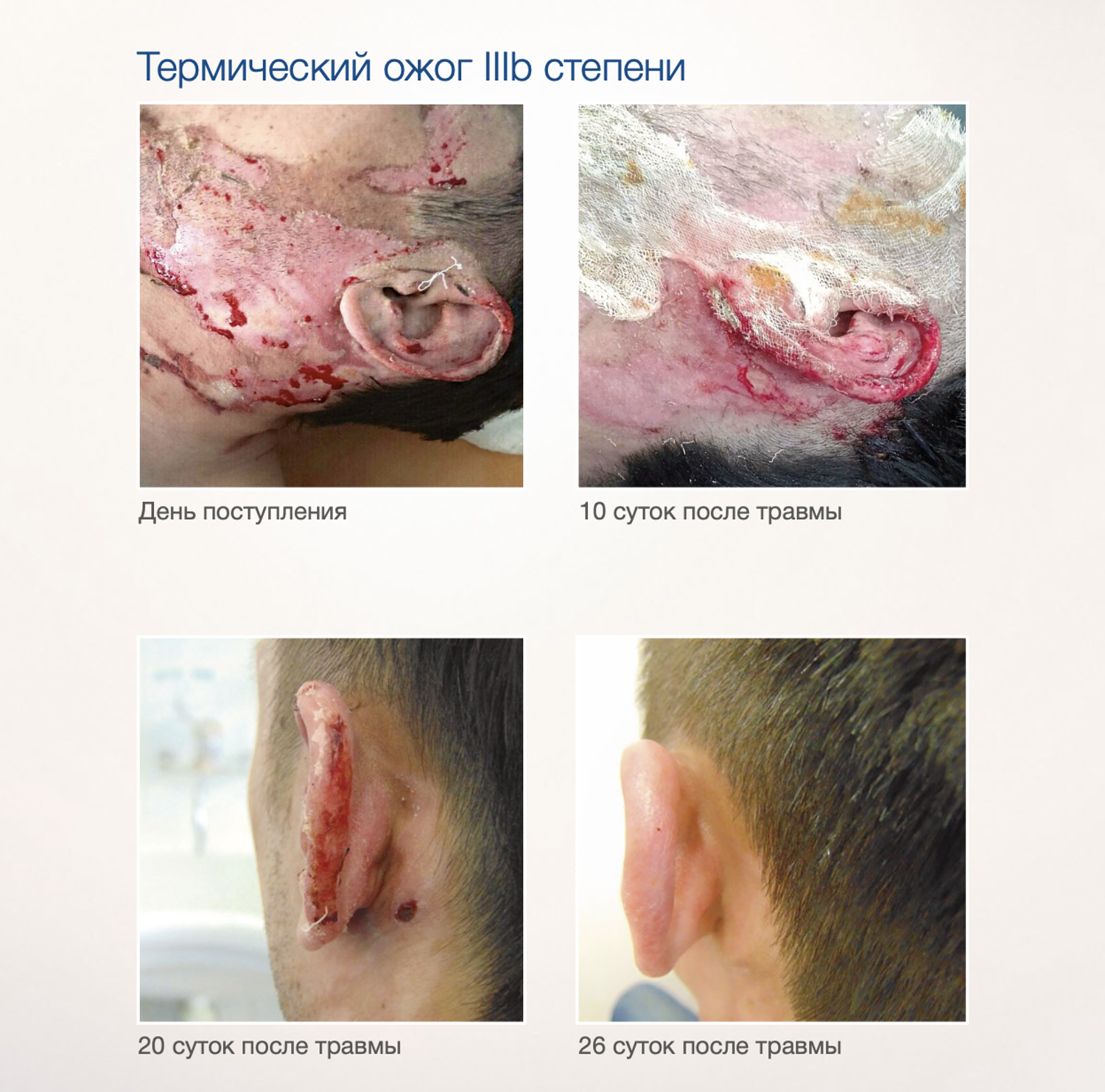
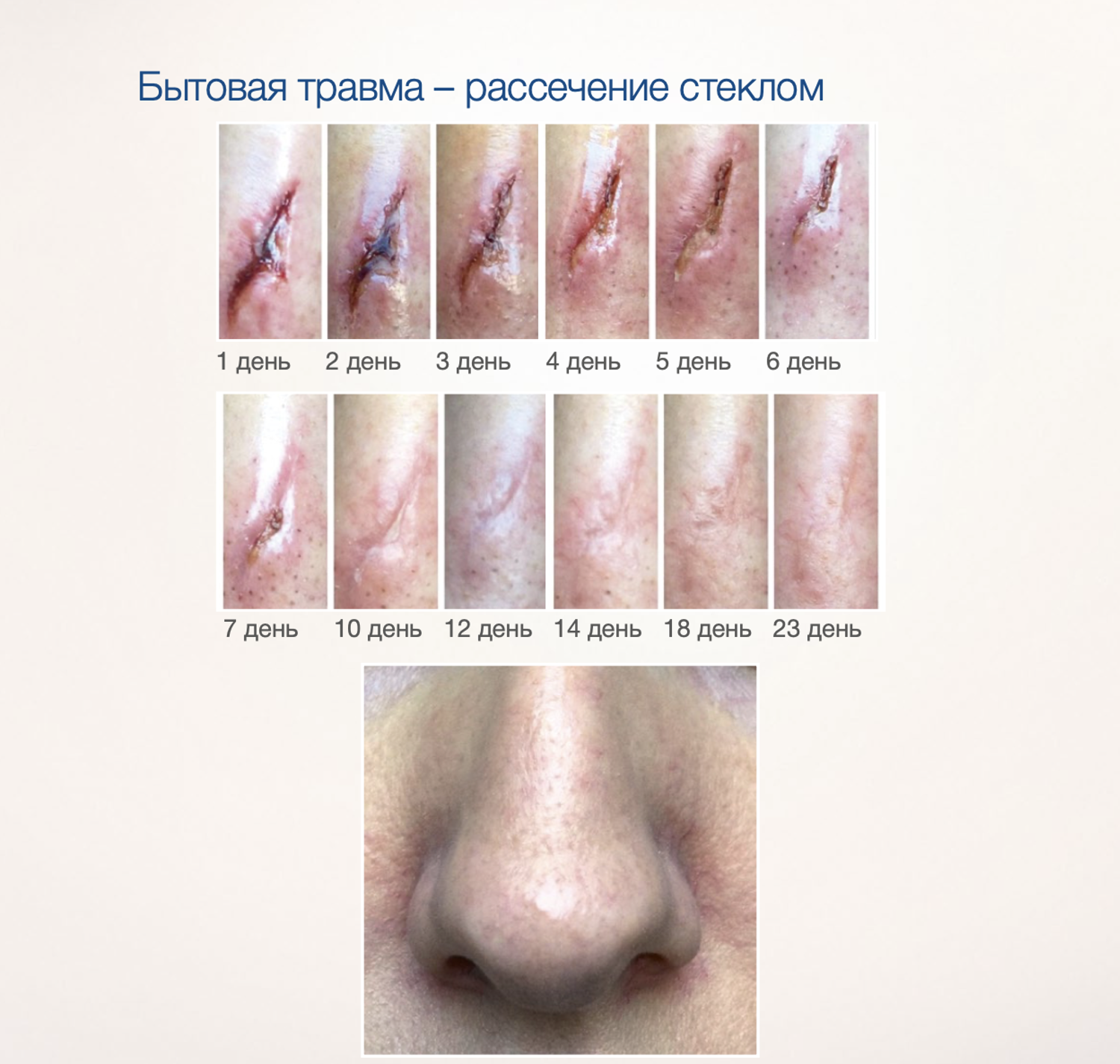
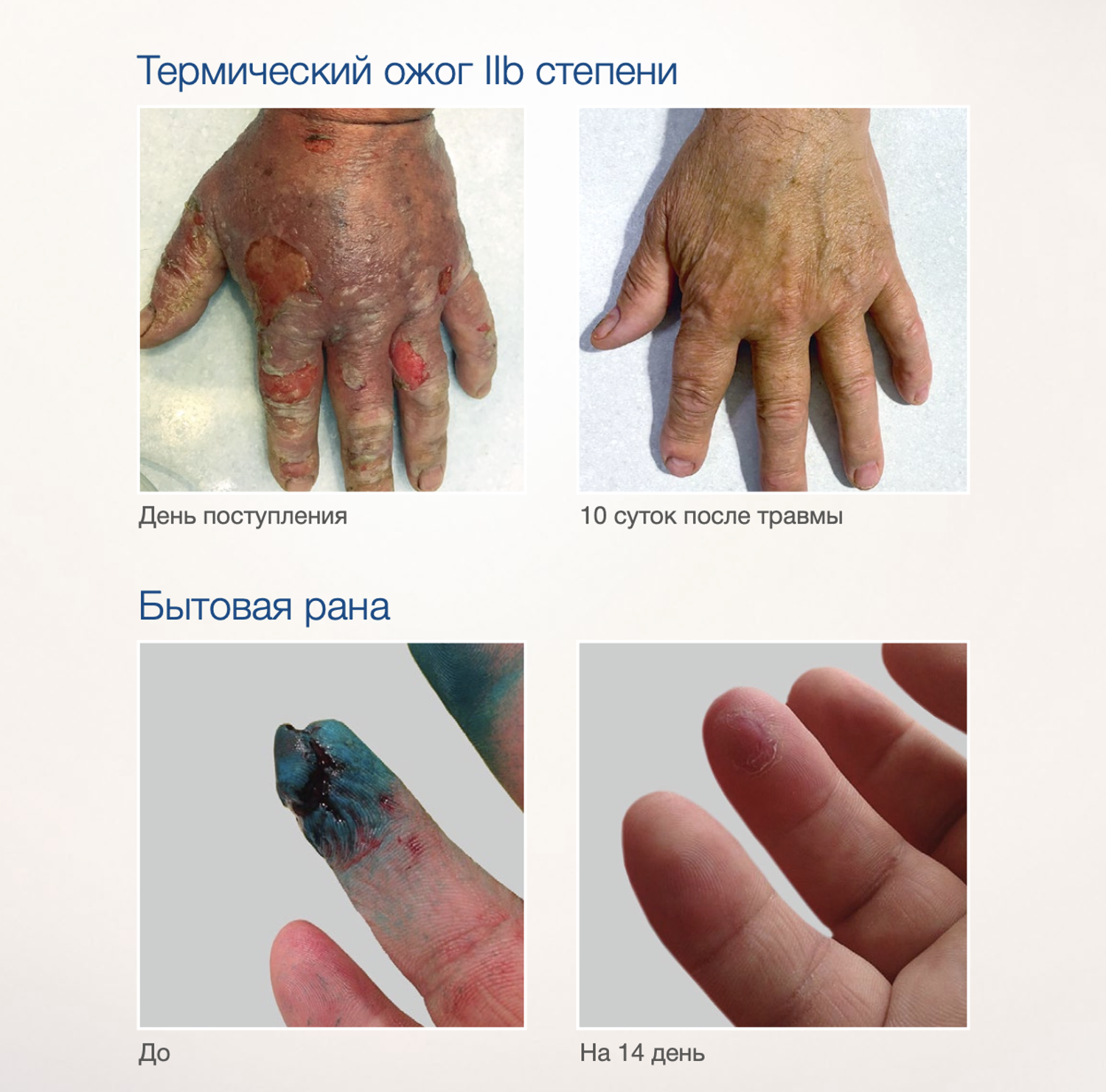
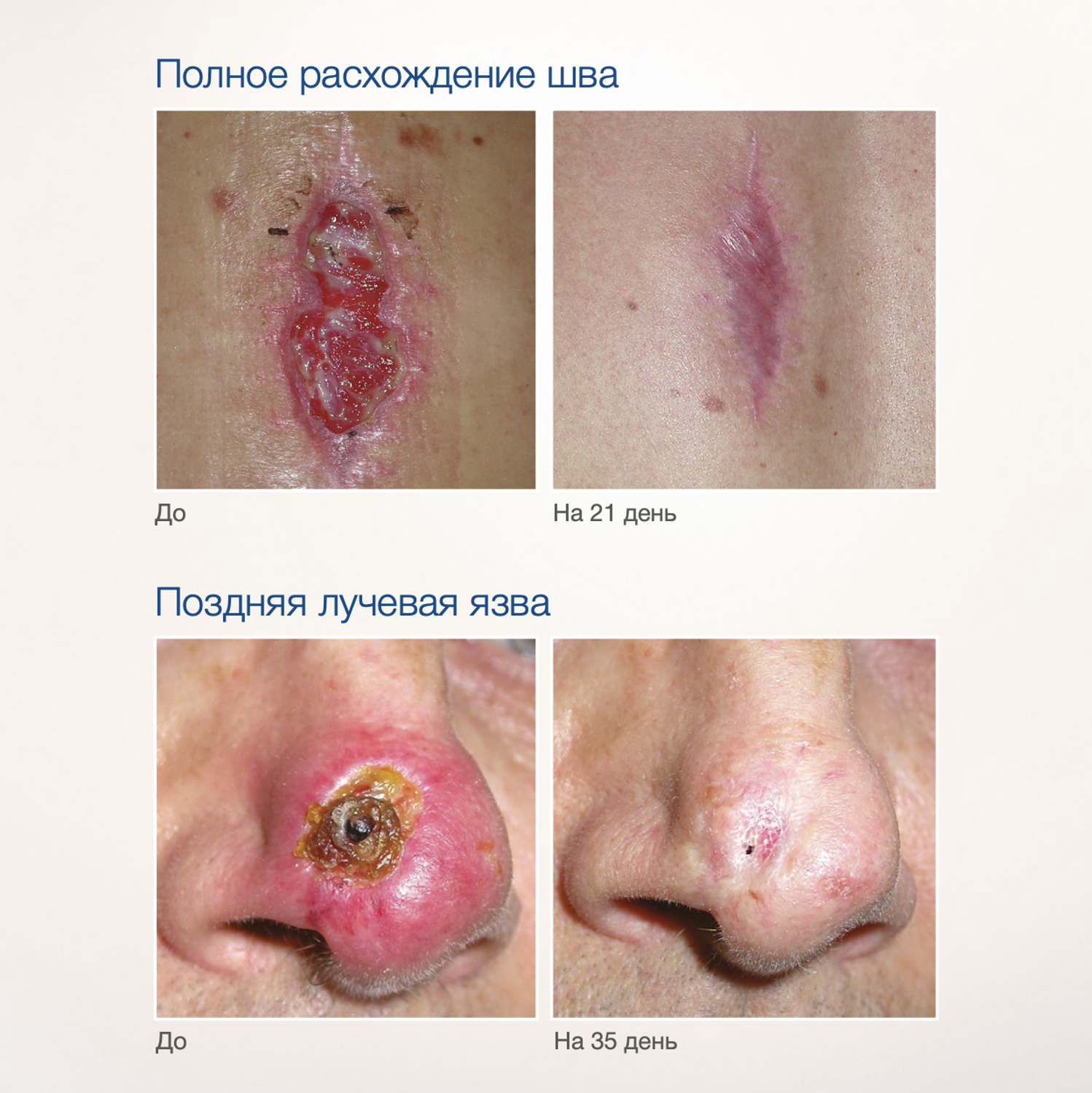
Сегодня, линейка Cellgel (ЦЕЛЬГЕЛЬ) представлена обилием фасовок, что даёт возможность выбрать нужный для использования объем.

10 лет подряд Cellgel (ЦЕЛЬГЕЛЬ) получает правительственные награды и входит в «100 лучших товаров России».





Глядя в глаза этой предводительницы племени короваев, до сих пор считающихся каннибалами, думается, что конечно будут и ещё впечатления в жизни, однако шок не отпускает до сих пор! Далее...
Поскольку чувство зуда является полностью субъективным ощущением, задачей дерматолога становится не только как можно более точное изучение жалоб больного, но и понимание объективных механизмов зуда... об этом и поговорим
Оценка безопасности поставляемой в рынок продукции, без которой реализация невозможна и незаконна, охраняя здоровье потребителя, не гарантирует ему заявленную производителем эффективность. Между тем, давно существует оборудование для оценки параметров кожи, которое в руках специалистов может быть использовано для объективной оценки эффективности косметической продукции и аппаратных методов.