Ключевые слова: лечение инфицированной раны, репарация, антибактериальный эффект, ранозаживляющее средство Cellgel
Необходимость в создании препаратов, обладающих одновременно антибактериальным и репаративным эффектом, остается актуальной и сегодня. Заживление раны - это сложный биологический процесс, включающий фазы воспаления, реэпителизации, образования грануляционной ткани и реорганизации внеклеточного матрикса [4]. Одним из важнейших условий этого процесса является нейтрализация и элиминация патогенов, всегда проникающих в рану.
Cellgel – ранозаживляющее средство, являющееся результатом сорбции на биополимере (гидроксиэтилцеллюлоза) коктейля биологически активных молекул, продуцируемых клетками куринного эмбриона. Экспериментальные работы с различными вариантами данного препарата, показали, что он обладает антибактериальной и репаративной активностью. Запатентованный препарат Cellgel (Патент № 2011141622 от 13.10.2011) был исследован в условиях эксперимента.
Цель исследования – изучить антибактериальные свойства ранозаживляющего средства Cellgel и его влияние на динамику заживления гнойной инфицированной раны.
Материалы и методы:
Эксперимент выполнен на 80 половозрелых кроликах – самцах. Содержание и экспериментальные процедуры проводились в соответствии с правилами Совета Европейского сообщества (Директива 86/309/ЕЕС от 24.11.1986). Использовалась модель инфицированной раны мягких тканей. (Патент № 2006122640 от 23.06.2006). Через 3 суток некротический струп удаляли механическим путем и в рану вносили 500 тыс КОЕ St. Aureus. Лечение животных начинали через 5 суток после формирования инфицированной раны мягких тканей.
Животные были разделены на 4 группы: экспериментальная группа и три группы контроля (по 20 кролов в каждой). В каждой группе 1 раз в сутки выполняли перевязку с определенным для каждой группы лекарственным веществом.
- «Экспериментальная группа» на рану наносили Cellgel.
- Группа «Контроль основы» на рану наносили только основу геля.
- Группа контроля «Традиционное лечение» лечение проводили в зависимости от фазы течения раневого процесса: в фазу воспаления применяли повязки с мазями на водной основе, в фазу регенерации и эпителизации – с мазями на жировой основе.
- Группа контроля «Без лечения».
На 1, 3, 5, 7, 10, 15 сутки оценивали размеры раневого дефекта, наличие отека, гиперемии, отделяемого из раны и его характер. В эти же сроки под местной анестезией выполняли биопсию раны через все слои на глубину до 1.8 – 2.2 см. Материал фиксировали в 96% этиловом спирте, заливали в парафин и готовили гистологические срезы, которые окрашивали гематоксилином Майера и эозином с последующим анализом морфологической картины [1,2].
Антибактериальная активность оценивалась по общепринятой методике «Определение чувствительности микробов к антибиотикам методом диффузии в агар с применением бумажных дисков» [3].
Результаты исследования
Диаметры зон подавления роста St. aureus 155 препаратом Cellgel, (32,7 ± 2,1 мм) достоверно больше «Гентамицина сульфата» (23,1 ± 1,8мм. соответственно). Гель также обладает высокой активностью в отношении E. Coli 2290 и B. cereus Jp 5832.
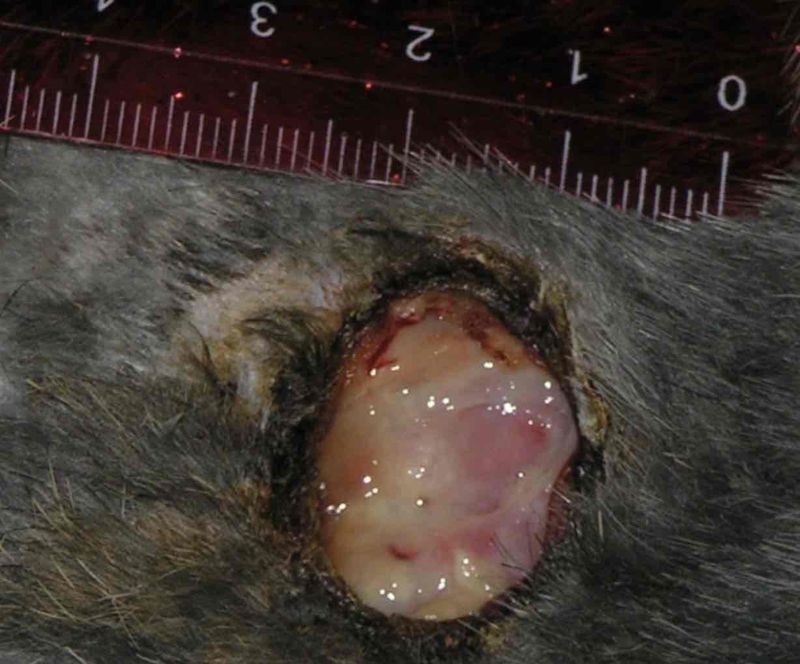
У всех животных были сформированы раны неправильно округлой формы 3.9-4.1 см в диаметре. Глубина раневого дефекта достигает 2 см. Вокруг раны очаг инфильтрации до 3.5 см в диаметре. Стенки раны гиперемированы, плотные, спаяны с окружающими тканями, дно покрыто плотным налетом фибрина, выделяется до 2-3 мл гнойного отделяемого белесоватого цвета тестоватой консистенции.
При гистологическом исследовании определяются очаги некроза в соединительной и мышечной ткани, расширение кровеносных сосудов со стазом крови, экссудация лейкоцитов. Сосочковый слой дермы имеет четкое разграничение на слои: с выраженной клеточной инфильтрацией, представленной моноцитами, единичными макрофагами и рыхлой соединительной тканью с большим количеством фиброцитов, единичными фибробластами, единичными моноцитами, плазмоцитами.
На 1 сутки в экспериментальной группе раневой дефект сохраняет свои размеры (4 ± 0.5 см в диаметре). Вокруг раны сохраняется умеренная гиперемия кожи, стенки раны мягкие при пальпации, дно раны покрыто налетом фибрина, гноя нет. На 3 сутки наблюдается уменьшение размеров дефекта ткани до 0.2 – 0.3 мм в диаметре, рана покрыта струпом бледно – серого цвета, вокруг располагается очаг эпителизации до 2.5 – 3.0 мм в диаметре. Гиперемия и инфильтрация вокруг раны не определяется. При гистологическом исследовании в ране определяется рыхлая соединительная ткань с небольшой лейкоцитарной инфильтрацией, единичными укрупненными фибробластами, лимфоцитами, плазмоцитами, эозинофилами и моноцитами. Очаги пролиферации эндотелия сосудов без просвета, с многорядностью расположения ядер. На 5 сутки дефект кожи отсутствует, определяется очаг эпителизации до 2 см в диаметре. Микроскопически поверхность покрыта многослойным плоским эпителием, подэпителиально определяется лимфоплазмоцитарная инфильтрация.
На 10 – 15 сутки эксперимента констатирована полная эпителизация раневого дефекта с его оволосением. Гистологически отмечается пролиферативная активность клеток фибробластического ряда, трубчатая пролиферация фибробластов и эндотелия сосудов. В подкожной клетчатке определяются неповрежденные нервные стволики, что соответствует гистологической картине эпителизации раны с сохранением всех функционирующих структур.
Во всех группах контроля на 1 сутки раны сохраняют свои размеры. При этом стенки ран сохраняют свою плотность, спаяны с окружающими тканями, вокруг раны сохраняется плотный инфильтрат, при механическом воздействии из раны выделяется гной, дно раны покрыто гнойной пленкой.
У животных 2 группы раны сохраняют свои размеры до 10 суток эксперимента, рана покрыта налетом фибрина, края и стенки раны плотные. При гистологическом исследовании определяется отек, лимфогистиоцитарная инфильтрация и дистрофически- дегенеративные изменения подкожной клетчатки, мышечного слоя. Закрытие раневого дефекта 22- 25 суткам эксперимента не происходит.
В группе 3 в течение раневого процесса прослеживаются все фазы: экссудации, пролиферации и регенерации. Закрытие раневого дефекта происходит к 20 - 25 суткам с формированием грубого соединительно – тканного рубца, гистологически в эти сроки сохраняются дистрофически- дегенеративные изменения подкожной клетчатки и мышц, дегенеративные изменения нервных стволиков.
В группе 4 у 5 животных на 5 – 10 сутки развилась флегмона подкожной клетчатки, что привело к гибели животных. У оставшихся мы не смогли добиться закрытия раневого дефекта к 25 – 30 суткам эксперимента и животные были выведены из эксперимента.
На наш взгляд, значительное (в 5 раз) ускорение очищения раны в первую фазу раневого процесса в экспериментальной группе по сравнению с группами контроля, а так же эпителизация раны без образования соединительнотканного рубца с восстановлением функции поврежденного участка (рост волосяного покрова) характеризуют потенцирование ранозаживляющим средством Cellgel механизмов физиологической репаративной регенерации.
Эффект применения препарата Cellgel позволяет сделать вывод о его потенциирующем влиянии на течение процессов репаративной регенерации.
Литература
- Гистологическая техника:Учебное пособие / Под редакцией В.В.Семченко, С.А.Барашкова, В.Н. Ноздрина, В.Н.Артемьева. – Омск-Орёл: Омская областная типография, 2006.
- Принципы иметоды гистоцитохимического анализа в патологии, под ред. А.П. Авцына и др., Л., 1971, библиогр.
- Bauer A.W., Kirby W.M.M., Sherris J.C., Turck M // Am. J. Clin. Path. - 1966. - Vol. 45. - P. 493-496.
- Singer A.J., Clark R.A.F. Cutaneous wound healing // New Engl. J. Med. — 1999. — Vol. 341. — P. 738–746.